
14.下列说法不正确的是 ( )
A.碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大
B.同一种物质气态时熵值最大,液态时次之,而固态时熵值最小
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.在一定条件下,非自发进行的反应也能够发生
13.在一定条件下,其密闭容器中发生了如下反应:2SO2(气)+O2(气) 2SO3(气)(反应放热)平衡后,SO2、O2、SO3的物质的量之比为3∶2∶5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为 ( )
2SO3(气)(反应放热)平衡后,SO2、O2、SO3的物质的量之比为3∶2∶5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为 ( )
A.1.8mol B.2mol C.2.2mo D.2.4mol
12.可逆反应mA(气)+nB(固) rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列叙述中正确的是 ( )
rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列叙述中正确的是 ( )
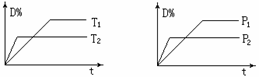
A.温度降低,化学平衡向正反应方向移动
B.使用催化剂,D的物质的量分数增加
C.化学方程式系数m<r+q
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
11.已知反应:PCl5(g)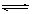 PCl3(g)+Cl2(g) ①2HI(g)
PCl3(g)+Cl2(g) ①2HI(g)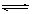 H2(g)+I2(g)
②2NO2(g)
H2(g)+I2(g)
②2NO2(g)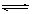 N2O4(g)
③在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各反应的温度和容器的体积都不改变,分别在加入一定量的各自的反应物,则转化率 ( )
N2O4(g)
③在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各反应的温度和容器的体积都不改变,分别在加入一定量的各自的反应物,则转化率 ( )
A.均不变 B.均增大
C.①增大,②不变,③减小 D.①减小,②不变,③增大
10.可逆反应aA(g)+bY(g)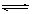 cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图像图下图所示,下列说法正确的是( )
cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图像图下图所示,下列说法正确的是( )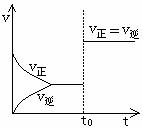
A.只能通过加入催化剂实现
B.可能通过增大压强来实现
C.可能通过升高温度实现
D.a+b一定不等于c
9.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)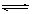 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 ( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 ( )
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的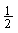
|
D.若升高温度,X的体积分数增大,则该反应的△H>0
8.为验证物质的浓度对化学反应速率的影响,配制1mol·L-1的盐酸置于大烧杯中,并取
3ml0.1mol·L-1的Na2S2O3溶液与3ml该盐酸反应,产生明显浑浊约需80s。第二天又用
3ml0.2mol·L-1的Na2S2O3溶液与原该盐酸3ml反应,产生浑浊的时间也需80s左右(已知:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O)。下列关于该实验的评价及结论正确的是
A.浓度对反应速率的影响不大
B.第二天所用的盐酸浓度变稀
C.该反应用盐酸表示的速率与用硫代硫酸钠表示的速率数值相等
D.任何化学反应,反应时间相同,化学反应速率均相同
7.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。 ( )
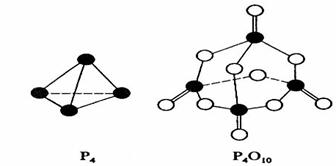
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
6.化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是 ( )
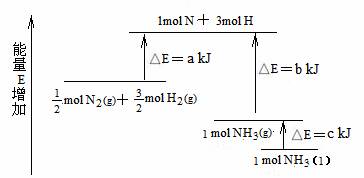
A.N2(g)+3H2(g) = 2NH3(l);△H = 2(a-b-c)kJ/mol
B.N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b-a)kJ/mol
C.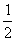 N2(g)+
N2(g)+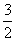 H2(g) = NH3(l) ;△ H
=(b+c-a)kJ/mol
H2(g) = NH3(l) ;△ H
=(b+c-a)kJ/mol
D.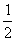 N2(g)+
N2(g)+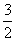 H2(g) =NH3(g) ;△H =(a+b)kJ/mol
H2(g) =NH3(g) ;△H =(a+b)kJ/mol
5.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为 ( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com