
6.下列说法不正确的是
A.电解质溶液导电的过程实际上就是电解的过程
B.利用电解饱和食盐水所得的产物可以生产盐酸
C.化学反应的限度越大,则所有反应物的转化率就一定越大
D.氢氧燃料电池的负极通入的是氢气
5.下列溶液一定显酸性的是
A.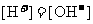 的溶液 B.pH<7的溶液
的溶液 B.pH<7的溶液
C.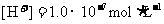 的溶液 D.
的溶液 D.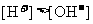 的溶液
的溶液
4.下列说法正确的是
A.强电解质在稀的水溶液中全部以离子的形态存在
B.弱电解质在水溶液中溶解度都很小
C.强电解质的水溶液导电性一定比弱电解质的水溶液导电性强
D.常温时,电解质溶液的pH都在0到14之间
3.下列物质的水溶液能导电,但属于非电解质的是
A.FeCl3 B.NH3 C.NH4HCO3 D.Cl2
2.下列过程需要通电后才能进行的是
①电离 ②电解 ③电镀 ④电化学腐蚀
A.①②③ B.②③ C.②④ D.全部
1.下列说法正确的是
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当高温时,反应可能自发进行
28、(6分)将一块质量为29.2g表面被氧化了(氧化物按Na2O计)的金属钠,投入到71.8g水中,产生了11.2L(标准状况)气体。试求:
(1)金属钠的纯度;
(2)所得溶液的质量分数。
27、(4分)今有H2、Cl2混合气体100mL(标准状况),其中一种气体体积为45mL,另一种气体体积为55mL。光照后,为了证明反应后气体中H2或Cl2有剩余,使气体通过10mL 水,并使剩余气体干燥后恢复到标准状态,若:
(1)剩余_________mL气体时,证明有H2剩余,理由是_________________________。
(2)溶液有_________性,证明Cl2剩余,理由是________________________________。
26、(11分)实验室欲配制500 mL0.2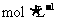 的Na2SO4溶液。
的Na2SO4溶液。
(1)通过计算可知,应用托盘天平称量_________克Na2SO4固体。
(2)本实验所需仪器为(填序号)_________,此外还必须添加的仪器为_________。
A、量筒 B、托盘天平和砝码 C、烧杯 D、漏斗
E、250容量瓶 F、500容量瓶 G、药匙 H、胶头滴管 I、坩埚
(3)从下面选出所需的操作并写出正确的顺序_________。
A、洗涤 B、干燥 C、量取 D、称量 E、定容 F、转移溶液
G、稀释 H、溶解
(4)在使用容量瓶之前必须进行的操作是___________________________。
(5)在实验过程中出现如下情况应如何处理?
①加蒸馏水不慎超过了刻度____________________________________
②加蒸馏水离刻度线约1-2cm处时应__________________________
③俯视观察到液面刚好到达刻度线, 应_________________________
25、(11分)A、B、C、D、E五种物质的转化关系如下图所示:
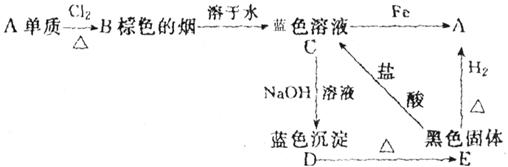
(1)确定A、B、C、D、E各为什么物质:
A、_________,B、_________,C、_________,D、_________,E、_________。
(2)写出下列各步反应的化学方程式:
C→D:_____________________________________________;
E→C:_____________________________________________;
C→A:_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com