
3.野外作业时,可用原电池反应放出的热量来加热食品。由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑作 ( )
A.正极,发生还原反应 B.负极,发生氧化反应
C.阴极,发生还原反应 D.阳极,发生氧化反应
2.下列物质中,既含有离子键,又含有非极性共价键的物质是 ( )
A.MgCl2 B.Na2O2 C.H2 D.NaOH
1.金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关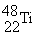 和
和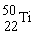 的说法中正确的是 ( )
的说法中正确的是 ( )
A.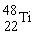 和
和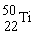 原子中均含有22个中子
原子中均含有22个中子
B.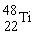 和
和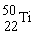 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.分别由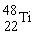 和
和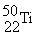 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
D.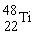 与
与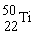 为同一核素
为同一核素
27.(6分)铜和镁的合金8.8g完全溶于浓硝酸,若反应中硝酸被还原只产生6.72L的NO2气体和1.12L的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,求生成沉淀的质量。
26.(6分)某温度下的CuSO4溶液200克,蒸发掉31克水,恢复到原温度,或向其中加入25克CuSO4·5H2O晶体,均可使溶液达到饱和。试计算:
(1)该温度下CuSO4·的溶解度。
(2)原溶液中溶质的质量分数。
25.(14分)短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
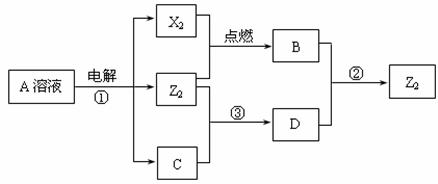
(1)Y在周期表的位置是_______________________;Z2的电子式是_________________。
(2)反应①的化学方程式是___________________________________________________。
(3)D溶液呈碱性的原因是(用离子方程式表示)_________________________________; D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。
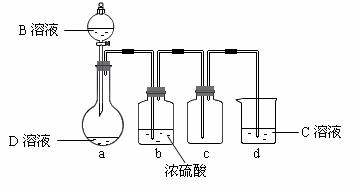
I、写出反应②的离子方程式_____________________________。
II、上述实验装置不够完善,改进方法是 。
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是
3Z2+6C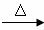 5A+YZO3+3H2O ,3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是__________。
5A+YZO3+3H2O ,3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是__________。
24.(8分)实验室用98%、密度为1.84 g / cm3的硫酸,配制浓度为0.46 mol / L的稀硫酸溶液200 mL。
(1)下面为实验过程中部分操作,正确的顺序为
①用量筒量取浓硫酸;②洗涤烧杯和玻璃棒3次并将洗涤液转移到容量瓶内;③振荡摇匀;④稀释浓硫酸;⑤用胶头滴管加水至刻度;⑥将稀释后的稀硫酸转入容量瓶
(2)回答下列问题
①稀释浓硫酸的操作:_____________ __
②用量筒量取浓硫酸 mL
③量取浓硫酸的体积时,如果仰视读数,则配制的稀硫酸的物质的量浓度偏 (高或低)
23.(8分)在120℃时分别进行如下四个反应:
A.2H2S+O2═2H2O+2S B.2H2S+3O2═2H2O+2SO2
C.C2H4+3O2═2H2O+2CO2 D.C4H8+6O2═4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合系式d(前)=d(后)和P(前)>P(后)的是 ;符合关系式d(前)=d(后)和P(前)=P(后)的是 (请填写反应的代号)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合系d(前)>d(后)和V(前)<V(后)的是 ;符合d(前)>d(后)和V(前)>V(后)的是 (请填写反应的代号)。
22.(8分)有M、A、B、D、E五种短周期元素,原子序数依次增大。M元素的单质是自然界最轻的气体。A、B、D、E分别在下表(周期表的一部分)占有相应的位置,它们的原子序数之和为37。试回答:
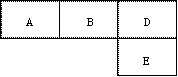
(1)在A、B、D、E四种元素的最简单氢化物中,沸点最高的是____(填化学式),由D、E两种元素组成的化合物属于__ _晶体。
(2)A、B、D、M可组成多种18电子分子,其中两种的结构可分别表示为M2B-BM2和AM3-BM2,请根据这两种分子的结构特点再写出2种具有18电子的有机物的结构简式(用元素符号表示)______________________、______________________。
21.(10分)A,B,C,D是原子序数不超过20的四种元素,它们的最高正价依次为+1,+4,+6,+7,其核电荷数按B,C,D,A的次序增大;已知B原子的次外层电子数为2.试回答:
(1)比较A、C、D形成简单离子的半径大小(写离子符号): > >
(2)比较B、C、D最高价氧化物对应水化物的酸性强弱(写化学式): __ > >
(3)写出A与D形成化合物的电子式: B与C形成的化合物的电子式: 它是由 (极性或非极性)键形成的 (极性或非极性)分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com