
26.(10分)在某温度下,将H2和I2蒸气各0.10mol充入体积为10L的密闭容器中,发生反应: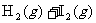

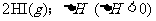 △。达到平衡后,测得
△。达到平衡后,测得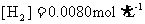 。
。
(1)该反应的平衡常数K=____________。
(2)温度升高时,平衡常数K将____________(填“减小”、“增大”或“不变”)。
(3)在上述温度下,若向另一相同的容器中通入H2和I2蒸气各0.20mol,则达到化学平衡状态时,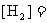 ____________,
____________,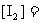 ____________,
____________,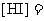 ____________。
____________。
25.(10分)
(1)在容积为3L的密闭容器中进行反应: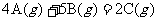 。开始时A为8mol,B为12mol,2s后A为2mol,则以B表示该反应的化学反应速率为____________,以C表示该反应的化学反应速率为____________。
。开始时A为8mol,B为12mol,2s后A为2mol,则以B表示该反应的化学反应速率为____________,以C表示该反应的化学反应速率为____________。
(2)在同温同压下,分别用惰性电极电解足量的下列溶液:①饱和食盐水,②CuCl2溶液,③CuSO4溶液,④NaOH溶液。电解一段时间,消耗相同的电量时,生成气体体积由大到小的顺序是____________(用序号表示)。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。己知0.2mol液态肼与足量液态过氧化氢反应生成水蒸气时,放出128kJ的热量。请写出该反应的热化学方程式:________________________________________________。
24.如下图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为: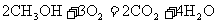 。下列说法中正确的是
。下列说法中正确的是

A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为: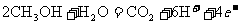
D.电池的正极反应式为: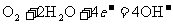
第Ⅱ卷(非选择题 58分)
23.一定条件下,在体积不变的密闭容器内,可逆反应: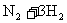

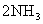 达到平衡,测得N2的体积分数为30%,改变温度后,反应重新达到平衡,N2的体积分数变为25%,则改变温度前后容器内气体的物质的量比为
达到平衡,测得N2的体积分数为30%,改变温度后,反应重新达到平衡,N2的体积分数变为25%,则改变温度前后容器内气体的物质的量比为
A.6︰5 B.5︰6 C.5︰4 D.3︰4
22.某可逆反应

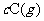 ,在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量
,在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量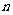 与时间
与时间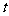 的关系曲线如下图所示。据图分析,以下正确的是
的关系曲线如下图所示。据图分析,以下正确的是
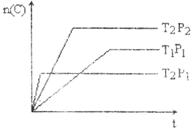
A.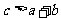 ,正反应为吸热反应 B.
,正反应为吸热反应 B.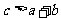 ,正反应为放热反应
,正反应为放热反应
C.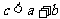 ,逆反应为吸热反应 D.
,逆反应为吸热反应 D.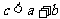 ,逆反应为放热反应
,逆反应为放热反应
21.一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应: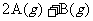

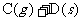 。达到平衡时,测得压强为原压强的
。达到平衡时,测得压强为原压强的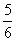 。则A的转化率为
。则A的转化率为
A.25% B.40% C.50% D.75%
20.高温下,某反应达平衡,平衡常数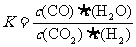 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
A.升高温度,逆反应速率减小
B.恒温恒容下,增大压强,H2浓度一定减小
C.该反应的焓变为正值
D.该反应化学方程式为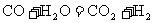
19.食盐中添加有KlO3,KIO3在工业上是以石墨和铁作电极,用电解KI溶液的方法制取。以下有关说法不正确的是
A.电解时,石墨作阴极,铁作阳极
B.阴极的电极反应式为: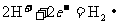
C.电解过程中阳极周围溶液的pH变小
D.理论上每生成1 molKIO3,则电路中流过6mol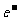
18.在同温同压下,下列各组热化学方程式中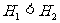 的是
的是
A.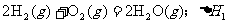
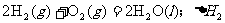
B.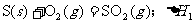
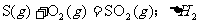
C.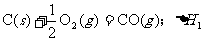
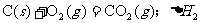
D.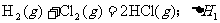
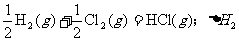
17.电解100mL含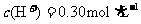 的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.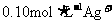 B.
B.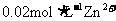
C. 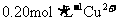 D.
D.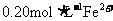
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com