
23.(9分)为测定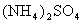 和
和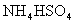 固体混合物的组成,现称取该样品四份,分别加入相同物质的量浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出[
固体混合物的组成,现称取该样品四份,分别加入相同物质的量浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出[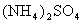 和
和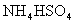 固体分解的温度均高于200℃],测得有关实验数据如下(标准状况):
固体分解的温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量(g) |
NaOH溶液的体积(mL) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中发生的有关反应的离子方程式为________________________。
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为____________;
(3)该混合物中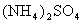 和
和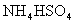 的物质的照之比为____________;
的物质的照之比为____________;
(4)欲计算该NaOH溶液的物质的量浓度,应选择第____________组数据,由此求得NaOH溶液的物质的量浓度为____________。
22.(12分)实验室刚氨气还原氧化铜的方法测定铜的相对原子质量,反应的化学方程式为: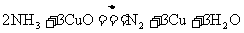
(1)如果选用测定反应物CuO和生成物H2O的质量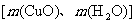 时,请用图中所列仪器设计一个简单的实验方案。
时,请用图中所列仪器设计一个简单的实验方案。
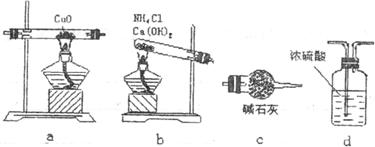
①仪器连接的顺序(用字母编号表示,仪器可重复使用)是________________,d中浓硫酸的作用是______________________________________________。
②装置b中发生反应的化学方程式为_______________________________。
③列出计算Cu的相对原子质量的表达式____________________________。
④下列情况将使测定结果偏大的是___________。
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用如图所示的仪器装置,其他方案可选用测定的物理量有_________。
A.m(Cu)和m(CuO) B.m(N2)和m(H2O)
C.m(Cu)和m(H2O) D.m(NH3)和m(H2O)
21.(8分)下图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物。它们存在如图所示的转化关系,反应中生成的水及次要产物均已略去。
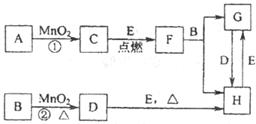
(1)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是_______剂。
(2)若反应①是在加热条件下进行,则A是_________;若反席①是在常温条件下进行,则A是_________。
(3)写出B与MnO2共热获得D的化学方程式___________________________。
(4)写出B与F反应的离子方程式____________________________________。
20.(6分)已知氧化性强弱顺序为BrO2>ClO2>Cl2>IO2>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是_________________________________________________。
(2)按现象出现的先后顺序写出有关的离子方程式(第2个离子方程式可不配平):__________________________________________________________________。
19.(6分)某白色同体混合物,可能含有NaHSO4、BaCl2、MgCl2、NaCl、NHCO3、NaAlO2(或Na[Al(OH)4])中的一种或儿种,对试样进行检测,有如下的实验现象:①取少量该固体物质,加水溶解,最终得到澄清溶液,没有沉淀和气体;②向所得澄清溶液中滴加NaOH溶液,有白色沉淀生成,加至过量时沉淀消失。
请回答下列问题:
(1)原混合物中一定含有的物质是___________(写化学式,下同);
(2)原混合物中一定不含有的物质是______________________。
18.(8分)六种短周期元素A、B、C、X、Y、Z,原子序数依次减小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物:C与X处于同周期,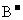 与
与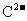 的核外电子排布相同,A与B处于同周期,且可形成BA型化合物。请回答:
的核外电子排布相同,A与B处于同周期,且可形成BA型化合物。请回答:
(1)Y元素的名称是___________;
(2)XZ3化合物的电子式是___________;
(3)A、B、C的离子半径由大到小的顺序为___________(用元素离子符号表示);
(4)化合物XZ4A中所含有的化学键类型为_________________________________;
(5)元素组成为XZ5YC3和BCZ(足量)的化合物在溶液中加热时反应的离子方程式为____________________________________________。
17.A是一种常见的单质,B、C为中学化掌常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
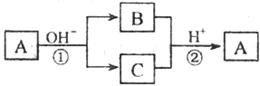
A.X元素可能为Al B.X元素一定为非金属元素
C.A可能是Cl2 D.反应①和②一定为氧化还原反应
第Ⅱ卷(非选择题 共49分)
16.向含1mol HCl和1mol MgSO4的混合溶液中加入1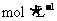 的
的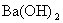 溶液,产生沉淀的物质的量(n)与加入
溶液,产生沉淀的物质的量(n)与加入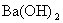 溶液的体积(V)之间的关系图正确的是
溶液的体积(V)之间的关系图正确的是
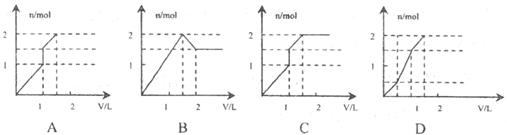
15.粗碘中通常含有ICl和IBr,称为卤素互化物,其性质和卤素相似,都是较强的氧化剂,而且受热时ICl和IBr都像I2一样能升华。在粗碘中加入下列选项中的一种物质后,再进行升华可得到精碘,则应加入的物质是
A.H2O B.KI C.Zn D.KCl
14.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
A.
B.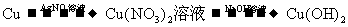
C.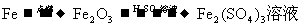
D.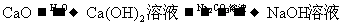
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com