
4.科学家在研究物质时,常常对物质进行分类,以便对同类物质的组成和性质进行共性研究。现有①氯气:②盐酸;③食盐水;④小苏打;⑤氢氧化钾:⑥石油。对上述物质的分类全部正确的是( )
A.盐-③④ B.纯净物-④⑤⑥
C.碱一①⑤ D.混合物-②③⑥
3.设NA为阿伏加德罗常数,下列说法中正确的是( )
A.分子数目为NA的氢气所占的体积为22.4L
B.2 mol二氧化碳气体所含分子总数为2NA
C.0.1 mol·L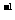 的NaCl溶液中,Na+与Cl
的NaCl溶液中,Na+与Cl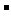 离子总数为0.2NA
离子总数为0.2NA
D.17gNH3中所含原子数为NA
2.在科学史上中国有许多重大的发明和发现,它们为世界的现代化发展奠定了基础,以下发明和发现属于化学史上中国对世界的贡献的是( )
①火药;②指南针;③造纸:④印刷技术;⑤炼铜、炼铁、炼钢:⑥合成有机高分子材料;⑦人工合成牛胰岛素(蛋白质);⑧提出原子、分子学说
A.②④⑥⑧ B.①③⑤⑦ C.④⑤⑥⑧ D.②③⑤⑧
1.在国际单位制中,物质的量的基本单位是( )
A.千克 B.摩尔 C.克/摩尔 D.摩尔/升
29.(15分)过氧化氢(H2O2)又称双氧水,常温下它是一种液体,它难电离,且易分解。随着社会需求的增长,尤其是生态环境保护的需要,过氧化氢近年来更受到人们的青昧,并称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。
根据上述材料,回答下列问题:
(1)依据你已有的知识,写出H2O2的结构式_______________________。你认为H2O2被称为绿色氧化剂的主要原因是:__________________________。
(2)S2Cl2的分子结构与H2O2类似,电子式为 ,属 分子(填极性或非极性)。
(3)H2O2是一种二元弱酸,其电离方程式为:
它与过量的Ba(OH)2反应的化学方程式为:________________________________。
(4)H2O2还有一定的还原性,能使酸性KMnO4溶液褪色,其离子反应方程式为 。
(5)我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:___________________________________。
(6)下列物质不会使过碳酸钠失效的是____________。
A.MnO2 B.H2S C.CH3COOH D.NaHCO3
28.(14分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)Z的原子结构示意图为 ;化合物BA4的电子式为 。
(2)化合物Y2X2中含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是 (填化学式),其主要原因是 。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 。
(5)常温常压下,由A、B、X可组成的液态物质甲。现有2.3g甲与足量的X的单质充分反应,生成标准状况下2.24L的BX2气体和2.7g的A2X液体,同时放出68.35kJ的热量,该反应的热化学方程式为: 。
27.(20分)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是____________(填元素符号),写出该元素的任意3种含氧酸的化学式:_______________________。
(3)D和Y形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属_______________,其晶体类型属________。
(5)金属镁和E的单质在高温下反应得到的产物是__________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低,并说明理由: 。
26.(本题共11分)
I(3分)下列有关实验的叙述中,正确的是 (填序号)。
①将浓盐酸逐滴滴入装有浓硫酸的烧瓶中,可以制取HCl气体。
②配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时须再加入蒸馏水至刻线
③配置100 mL 1.00mol/L的NaCl溶液时,可用托盘天平称取5.85 gNaCl固体。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤分液漏斗分液时,先将下层的液体从下口流出,然后再从下口流出上层的液体
⑥测定某溶液pH时,取一小块干燥的试纸放入玻璃片上,用玻璃棒蘸取溶液滴在试纸的中部,再与标准比色卡对比
⑦向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
⑧测硫酸铜晶体中结晶水的含量至少需要称量3次
Ⅱ(8分)Na2CO3是一种很重要的化学物质,某中学某学生拟在实验室中用NaOH制Na2CO3溶液。下面是他的制备实验过程:
用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:①用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;②小心煮沸溶液1-2分钟;③在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)在步骤①中,刚通入CO2时发生反应的离子方程式是 ;而后又发生反应的离子方程式是 。
(2)步骤②中煮沸溶液的目的是 。
(3)步骤③中反应的离子方程式是 。
13.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3Sn2++18Cl-+aH3AsO3+bH+=aAs+3SnCl62-+cM关于该反应的说法中正确的组合是 ( )
① 氧化剂是H3AsO3;
② 还原性:Cl->As;
③ 每生成0.1 mol As,还原剂失去的电子为0.3mol;
④ M为OH-;
⑤ a=2,b=6。
A.只有①③ B.①③⑤ C.①②③④ D.①②④⑤
|
12.下列离子方程式正确的是 ( )
A.碘化亚铁溶液中通入少量氯气 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
B.少量SO2通入次氯酸钙溶液中 Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
C.用氨水吸收过量二氧化硫 NH3·H2O + SO2 = NH4+ + HSO3-
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2 ═ Fe3++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com