
5.下列反应中,调节反应物用量或浓度,不会改变反应产物的是 ( )
A.铁粉在氯气中燃烧 B.硫酸中加入锌粉
C.CO2通入氢氧化钠溶液 D.铜和硝酸溶液反应
4.北京奥运会 “水立方” 游泳池中的水主要是通过砂滤、臭氧和活性炭来净化的,下列有关说法不正确的是 ( )
A.砂滤是利用过滤原理除去水中较大的固体颗粒
B.臭氧可以消毒杀菌是因为臭氧有强氧化性
C.游泳池水中的臭氧浓度越大越好
D.活性炭可以吸附水中悬浮的杂质
3.根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是 ( )
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.候氏制碱法
2.生活中处处有化学。下列做法中,你认为不科学的是 ( )
A.使用含氟牙膏可以预防龋齿
B.加明矾使海水中的盐分沉淀而使海水淡化
C.以二氧化硅为主要原料制备高性能通讯材料光导纤维
D.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
1.北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A.非金属单质燃烧时火焰均为无色 B.NaC1与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察 D.所有金属及其化合物灼烧时火焰均有颜色
22.(12分)某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究。
[提出假设]该反应中的气体产物可能是CO或者是CO2和CO的混合物。
[查阅资料]氮气不与碳、氧化铁发生反应。实验室可以用饱和氯化铵溶液和饱和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气。
[设计方案]如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
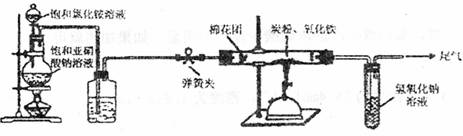
试回答下列问题:
(1)广口瓶内盛放的试剂为 ,其作用为
(2)实验开始时,应先打开弹簧夹,一段时间后关闭;再点燃酒精喷灯,理由是
(3)称取3.20g氧化铁、2.00g炭粉混合均匀,放入质量为48.48g的硬质玻璃管中;待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为51.24g。经进一步测定得知参加反应的氧元素质量为0.96g。从而确认该反应的气体产物是CO2和CO的混合物,理由是 。根据数据处理结果判断,反应产生的气体中n(CO2):n(CO)= 。
(4)有同学认为还应对该实验装置作进一步完善,你认为应作如何改进?
21.(12分)下列有某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol·L-1,密度为1.84g·cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10-15滴(约0.5mL),加热至沸腾,该试管中液体是否有明显变化 。(填“是”或“否”)
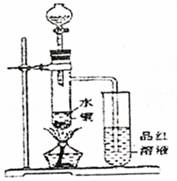
(2)甲同学再用分液漏斗加浓硫酸10mL后加热至沸腾,现象是 。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是 。为了最终看到与甲类似的现象,乙同学需进行的操作是: 。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是
。
20.(12分)某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:
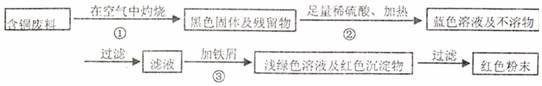
方案乙:
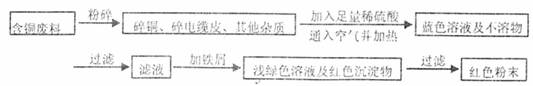
(1)两个方案哪个符合当前生产的绿色理念,为什么?
(2)写出方案甲中的②③步骤反应的离子方程式:
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简单方法检验红色粉末中是否含有过量的铁屑;如果有请你提出合理的处理方案
;
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、 、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
19.(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和H2,该反应的氧化剂是 ;H2还原过程中若混O2,可能引起的后果是 。(2)下列有关硅材料的说法正确的是 (填字母)。
A.晶体硅和二氧化硅晶体的结构都类似金刚石,都常用来制造电子部件。
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承。
C.普通玻璃是由纯碱、石灰石和石英砂为原料制成的,没有固定的熔点。
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅。
(3)三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。写出三硅酸镁与胃酸(盐酸)反应的化学方程式:
18.将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2dL(折算成标准状况)。则d等于 ( )
A.22.4bc×10-3 B.44.8bc×10-3
C.22.4(3a-4bc×10-3) D.22.4(3a-4bc)×10-3
第Ⅱ卷(非选择题,共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com