
3.反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列有关说法正确的是
A.NaI和NaIO3在一定条件下能反应生成I2
B.I2在反应①中是还原产物,在反应②中是氧化产物
C.两个反应中生成等量的I2时转移的电子数相等
D.氧化性:MnO2>IO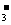 >I2>SO
>I2>SO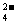 >Mn2+
>Mn2+
2.为实现“绿色奥运”,下列环保建议中你认为可以采纳的是
①用天然气代替汽油和柴油作为发动机燃料
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发利用无磷洗涤剂
A.①③④ B.②③④⑤ C.①②④⑤ D.全部
1.2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A.乙醇汽油是一种清洁能源,燃烧不会产生污染
B.乙醇与汽油组成元素相同,化学成分相似
C.乙醇汽油燃烧时,耗氧量高于等质量的汽油
D.乙醇可通过淀粉转化制得,是一种可再生的燃料
25.(10分)某研究性学习小组拟用铜屑与氧化铜的混合物与由硫酸和硝酸组成的混合酸反应来制取CuSO4·5H2O晶体,混合酸中硝酸的还原产物均为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2,反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480g,其中铜单质的质量分数为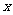 ,试回答下列问题:
,试回答下列问题:
(1)所得硫酸铜晶体的质量了为
g(用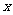 表示)。
表示)。
(2)若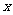 =0.4,则混合酸中HNO3与H2SO4的物质的量之比为
。
=0.4,则混合酸中HNO3与H2SO4的物质的量之比为
。
(3)若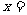 0.4,用480g固体混合物与一定量混合酸微热后,充分反应,冷却,恰好只得到CuSO4·5H2O,试求原混合酸中H2SO4的质量分数。
0.4,用480g固体混合物与一定量混合酸微热后,充分反应,冷却,恰好只得到CuSO4·5H2O,试求原混合酸中H2SO4的质量分数。
24.(8分)将一定量1.00mol/LCuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将0.499g X隔绝空气在1000℃以上强热,得到一种红色固体Y,质量为0.316g。Y溶于酸得到另一种红色固体0.141g。(Cu2O为红色,Cu2O十2H+==Cu2++Cu+H2O)
(1)混合时CuSO4和NaOH溶液的体积比为 ;写出X→Y的反应方程式 。
(2)通过计算确定X和Y的化学式。
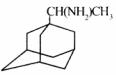
23.(10分)新华网北京2006年3月16日电,农业部防治高致病性禽流感工作新闻发言人贾幼陵说,广西南宁市和西藏拉萨市疫区已经解除封锁,“这标志着我国高致病性禽流感阻击战取得了阶段性成果”。金刚甲烷、金刚乙胺等已经批准用于临床治疗人类禽流感;金刚甲烷、金刚乙胺和达菲已经批准可用于预防人类禽流感。
(1)金刚乙胺,又名 一甲基-1-金刚烷甲基胺,其化学结构简式如下图所示,其分子式为
。
一甲基-1-金刚烷甲基胺,其化学结构简式如下图所示,其分子式为
。
(2)金刚乙胺是金刚乙烷的衍生物,金刚乙烷有很多衍生物,它们可以相互衍变。下图就是它的部分衍生物相互衍变图。
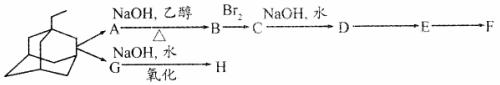
经检测发现,E分子中有两个C=O键,但与新制氢氧化铜反应得不到红色沉淀:1mol F与足量的钠完全反应生成22.4L气体(标准状况下);H具有酸性,且分子式中只比F少1个O。据此回答下列问题:(可用“R”表示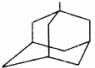 )
)
①写出D、H的结构简式:D ;H 。
②写出C+D的化学方程式: ;
A→B、E→F的反应类型分别为: 、 。
③ F在一定条件下可发生缩聚反应,形成高分子化合物I,试写出I的结构简式:
。
④金刚乙烷在一定条件下可发生氯取代,其一氯取代物有 种。
22.(8分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为: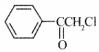 ,试回答下列问题:
,试回答下列问题:
(1)苯氯乙酮分子中,在同一平面上的碳原子最多有 个。
(2)苯氯乙酮不可能具有的化学性质是: (填序号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
(3)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子中有苯环但不含一CH3的化合物有多种,它们的结构简式是:
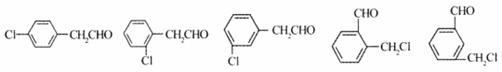
请写出与上述不同的两种同分异构体: ; 。
21。(10分)2001年11月20日,《解放日报》报道:南太平洋岛国“图瓦卢被迫全国移民” 到新西兰,该国前总理佩鲁曾声称图瓦卢是“温室效应的第一个受害者”。目前该国正面临生存环境严重恶化的局面,该国岛屿近20年来已经被海水侵蚀得干疮百孔,岛上的淡水日益减少;海水的大量侵入使土壤盐碱化,粮食和蔬菜无法正常生长。图瓦卢陆地最高处仅海拔4.5m,由于海平面日渐升高,据估计这些岛屿将于50年内被海水淹没。请根据以上材料分析:
(1)图瓦卢是由多个珊瑚礁形成的岛国,由于大气中CO2含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示) 。
(2)为了控制温室效应,各国科学家提出了不少方法和设想,有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减小大气中CO2的浓度。为使CO2液化,可采用的措施是 。
A.减压、升温 B.增压、升温 C.减压、降温 D.增压、降温
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1:4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源,请完成以下化学方程式:
CO2+4H2→( )+2H2O
若将CO2与H2混合,在一定条件下以1:3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是 。
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(4)在170-200℃时,用钴作催化剂,可生成C5-C8的烷烃,这是人工合成汽油的方法之一。在合成汽油的反应中,V(CO2):V(H2)的关系为 。
(5)已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述:①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一。其中正确的是 。
A.是①②③ B.只有① C.是①和② D.只有③
20.(10分)A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。
已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。
(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。
(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出)
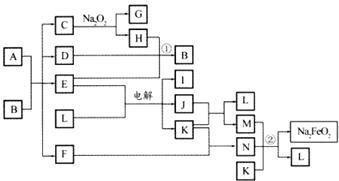
请填写以下空白:
(1)写出C的电子式: 。
(2)写出反应①的化学方程式: ,写出反应②的离子方程式: 。
(3)甲和乙的化学式分别为 、 ,若A中组成元素的物质的 量之比为4:9,则乙在A中的物质的量分数为 。
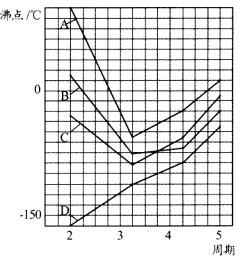
19.(8分)(1)图中A、B、C、D四条曲线表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物 的沸点变化曲线,其中A、D分别表示 、 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因 ;图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是 。
(2)已知氨分子内键与键的夹角约为107°18′。从反应NH3+H+→NH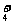 可知:NH
可知:NH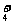 中有一根键比较特殊,其结构如下图a所示。但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109°28′。故NH
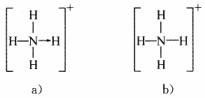
中有一根键比较特殊,其结构如下图a所示。但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109°28′。故NH 的结构如图b所示。
的结构如图b所示。
① 还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如:
等。
(在下列微粒中选择填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O,H3O+)
②写出H3O+的电子式: 。1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似,物理性质相近。据此,你认为H3O+中键与键的夹角与下列哪个角度最接近? 。
A.120° B.109°28′ C.107°18′ D.60°
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com