
2.下列无色气体中,常温时遇空气很容易变为红棕色的是 ( )
A.NH3 B.NO C.CO2 D.SO2
1.从防止环境污染的角度出发,最理想的能源是 ( )
A.煤 B.氢气 C.天然气 D.石油
24、(8分)已知: MnO2
+4HCl(浓)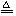 MnCl2
+ Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:(请写出计算过程)
MnCl2
+ Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:(请写出计算过程)
(1)用双线桥法表示出该反应的电子转移数目:MnO2
+4HCl(浓)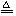 MnCl2
+ Cl2↑+ 2H2O
MnCl2
+ Cl2↑+ 2H2O
(2)反应耗用MnO2的质量 g
(3)被氧化的HCl物质的量 mol
(4)原浓盐酸的物质的量浓度 mol/L
23.(12分)氧化还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是 。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有 。 (填“氧化性”或“还原性”);
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式 。
22.(10分)有一包白色粉末,其中可能由K2CO3、、CaCl2、Ba(NO3)2,为检验它们,做了如下实验:
①将部分粉末溶于水,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,有白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
根据上述实验现象,判断原白色粉末中肯定含有什么物质,可能含有什么物质试判断:
(1) 原白色粉末中肯定有 ,可能有 ;(用化学式填写)
(2)写有关反应的离子方程式: ,
, 。
21.(6分)某同学用胆矾晶体(CuSO4·5H2O )配制0.40mol/L的CuSO4溶液1000mL,回答下列问题
(1)所需仪器为:容量瓶、托盘天平、药匙、 胶头滴管 ,还需要哪些玻璃仪器才能完成该实验,请写出: 。
(2)请写出该实验的简要的实验步骤①计算 ②称量胆矾 g ③ ④转移⑤洗涤并转移⑥定容⑦摇匀
(3)下图是该同学转移溶液的示意图,图中的错误是
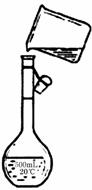
、 。
20、(4分)(1)我们学习了两种基本的分类方法:交叉分类法和树状分类法。
按照分散质粒子的大小,可以把分散系分为溶液、胶体和浊液三类。其中胶体粒子的大小在 nm之间。这种分类属于 法。
19、(4分)4HCl(浓) + MnO2
 MnCl2 + Cl2↑ + 2H2O反应中,MnO2与被氧化的HC的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
MnCl2 + Cl2↑ + 2H2O反应中,MnO2与被氧化的HC的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。
18、(4分)在标准状况下4.48L的NH3气体质量为 g,其中含 个H含 molN,将其溶于水配成200mL的溶液,其物质的量浓度为 mol/L 。
17、(4分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.渗析 G.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com