
2、下列反应类型中一定属于氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
1、下列化学反应中,不属于四种基本反应类型但属于氧化还原反应的是( )
A.Cu2(OH)2CO3==2CuO+ H2O+CO2
B.CaCO3+2HCl=CaCl2+ H2O+CO2
C.2FeCl3+Cu==2FeCl2+CuCl2
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
22.(6分) 如下图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
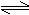 2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
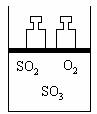
(1)在该平衡状态时n(SO3)=_________。
(2)若起始时n(SO2)=1.2mol,n(O2)=0.6mol,n(SO3)=x mol,达到平衡后各气体的体积分数与平衡状态A相同,则起始时x的取值范围为___________。
(3)若反应开始时的v逆>v正,达到上述平衡状态时,气体的总物质的量仍为4.2mol,则SO3起始物质的量x的取值范围是____________。
21.(9分)用中和滴定法测定某烧碱的纯度。
(1)配制待测液 将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,定容时所用的一种容积精确的仪器名称是______________。
(2)滴定 ①盛装0.20mol/L盐酸标准液应该用_______式滴定管。②滴定时,应先向锥形瓶中加酚酞作为指示剂,滴定终点时锥形瓶中的溶液的颜色变化是(从以下选项选择)_______。
A、由黄色变为红色 B、由黄色变为橙色C、由浅红色变为无色D、由无色变为红色
③有关数据记录如下:
|
滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
(3)纯度计算 (均保留三位有效数字)
NaOH溶液的浓度为______________mol/L,烧碱样品的纯度为____________
(4)对假定情况的讨论:(填无影响、偏高、偏低)
①若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果_________。
②读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
20.(10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中离子浓度关系是以上哪一种(选填序号) 。
(2)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
19.(6分) Al2(SO4)3水溶液呈____性,离子方程式表示原因是______________;把该溶液与小苏打溶液混合后反应的离子方程式是__________________________.
18.(12分)一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:
①原气体中一定含有_____________,一定不会有 ____________;
②最终结果可知原气体中______与______气体的体积比为_______。
17. (9分)配平下列化学(或离子)方程式:
(1)__MnO4-+__H++__H2O2- __Mn2++__O2↑+__H2O
(2)__Zn +__ HNO3- __Zn(NO3)2+__NH4NO3+__H2O
(3)在反应(2)中被还原的氮原子与未被还原的氮原子物质的量比为______。
16. 某温度下,在容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加2mol D.均减少2mol
第Ⅱ卷(非选择题 共52分)
15. 对密闭容器中进行的可逆反应4NH3(g)+5O2(g)
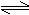 4NO(g)+6H2O(g),正确的是
4NO(g)+6H2O(g),正确的是
A.反应达到平衡时若两种反应物的转化率相等则起始投入的n(NH3)︰n(O2)=1︰1
B.反应达到平衡后,再向体系中充入O2,将提高NH3的转化率
C.反应达到平衡时,若向体系中充入稀有气体,速率增大
D.当V正(NH3)︰V正(NO)=1︰1时,说明该化学反应已经达到平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com