
18.(12分)为研究卤代烃的化学性质,某化学课外小组的学生进行如下实验。
(1)甲同学设计了图中A、B两个实验,充分振荡反应后,甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银的试管中,实验现象是 ,后从试管B (NaOH的浓度是0.5 mol/L)的水层中取出少许溶液,滴入盛装有足量硝酸酸化的硝酸银的试管中,实验现象是 ,写出该化学方程式 。A、B两个实验说明了 。
(2)乙同学在B的基础上,设计装置C研究氢氧化钠溶液和CH3Br反应。浸过乙醇的棉花的作用是 ,有人认为,控制装置C中的水浴是本实验的关键,应如何控制水浴温度 。
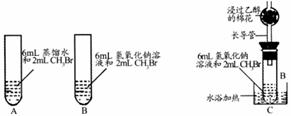
(3)丙同学将c(NaOH)从0.5 mol/L增大到1.0mol/L、1.5 mol/L,经过相同的时间(试管中还有油滴)后从试管B的水层中取出少许溶液,滴入盛装有足量硝酸酸化的硝酸银的 试管中,发现生成沉淀的质量依次增大,该现象说明 ,还可以通过其他实验操作说明该结论,简述另一种实验思想:
。
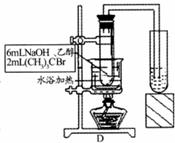
(4)丁同学用装置D研究(CH3)3C-Br和乙醇的反应,若试管中盛装足量溴水溶液,充分反应后,试管中的现象是 ,写出有关化学方程式 。
(5)对试管中的有机层进行分离,可得到少量(CH3)3C-Br、(CH3)3COC2H5和大量 (CH3)2CBr-CH2Br,写出生成(CH3)3COC2H5的方程式
。
17.(10分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m g铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HN0。分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
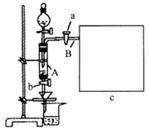
(1)如何检查装置的气密性: 。
(2)滴加盐酸时发现反应速率较之同浓度盐酸与铁反应要快原因是
。
(3)将烧杯内的溶液用蒸发、浓缩、再降温结晶法得到FeCl3·6H2O晶体,不采用直接蒸发结晶的方法制得晶体的理由是 。
(4)由该法制得的晶体中往往?昆有Fe(NO3)3,为了制得纯净的FeCl3·6H2O晶体,可将烧杯内的稀硝酸换成 。
(5)若测定废铁屑的纯度,可测出从B中放出气体的体积V(已折算成标准状况,单位:L),则废铁屑的纯度为 (用含m、V的代数式表示),请在框图c中画出必要的装置。
16.已知N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2 mol N2和8 mol H2达到平衡时生成1 mol NH3,现在相同条件下的同一容器中充入
2NH3(g);△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2 mol N2和8 mol H2达到平衡时生成1 mol NH3,现在相同条件下的同一容器中充入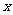 mol N2、
mol N2、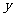 mol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2 kJ.则
mol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2 kJ.则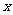 、y的值为
、y的值为
A.1.5,6.5 B.2,8 C.5,2l D.3,13
15.把一块镁铝合金投入到1 mol/L盐酸溶液中,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积的关系如图所示。则下列说法正确的是
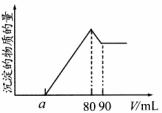
A.欲求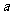 的取值范围至少还需要一个条件
的取值范围至少还需要一个条件
B.欲求n(Mg)/n(Al)的比值的最大值至少还需要二个条件
C.欲求n(Mg)/n(Al)的比值的最大值至少还需要一个条件
D.以上说法均不正确
14.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如图所示的转化关系(部分产物及反应条件已略去):下列判断正确的是
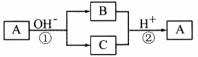
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
13.有一种锂电池用金属锂和石墨作电极材料,电解质溶液是四氯铝锂(LiAlCl4)溶解在亚硫酰氯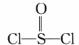 中形成的,电池总反应方程式为8Li+3SOCl2==6LiCl+Li2SO3+2S。下列叙述中正确的是
中形成的,电池总反应方程式为8Li+3SOCl2==6LiCl+Li2SO3+2S。下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
12.乙烯雌酚是人工合成的激素类药物,对垂体促性腺激素的分泌有抑制作用,能改善体内激素的平衡状态,破坏肿瘤组织赖以生长发育的条件,对治疗前列腺癌和乳腺癌有明显的疗效,其结构如图所示。下列有关叙述中不正确的是
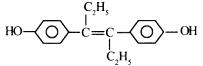
A.乙烯雌酚的分子式为Cl8H20O2
B.乙烯雌酚可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与5mol Br2发生反应
D.该有机物分子中一定有8个碳原子共平面
11.下列反应的离子方程式正确的是
A.氯化铝溶液中加入足量碳酸氢钠溶液:Al3+ +3HCO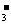 ==Al(OH)3↓+3CO2↑
==Al(OH)3↓+3CO2↑
B.向硅酸钠溶液中通入过量二氧化碳:
SiO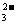 +2CO2+2H2O==H2SiO3↓+2HCO
+2CO2+2H2O==H2SiO3↓+2HCO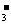
C.将铜片放入稀硝酸中加热:Cu+4H++2NO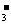 ==Cu2++2NO2↑+2H2O
==Cu2++2NO2↑+2H2O
D.H218O中投入Na2O2固体:2H218O+2O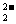 ==4OH
==4OH +18O2↑
+18O2↑
10.有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中 有一种是氩元素,则关于另外两种元素的说法不正确的是
A.如果一种元素是金属元素,则另一种元素一定是稀有元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是 正四面体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
9.在25mL0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是
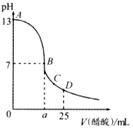
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO )>c(OH
)>c(OH )>c(H+)
)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO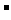 )=c(OH
)=c(OH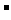 )=c(H+)
)=c(H+)
C.在C点:c(CH3COO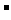 )>c(Na+)>c(H+)>c(OH
)>c(Na+)>c(H+)>c(OH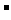 )
)
D.在D点:c(CH3COO )+c(CH3COOH)=2c(Na+)
)+c(CH3COOH)=2c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com