
8.一定条件下反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
7.已知充分燃烧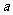 g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量
g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量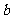 kJ,则乙炔燃烧的热化学方程式正确的是
kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1);
△H=-2b kJ·mol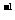
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(1);
△H=+2b kJ·mol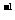
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1);
△H=-4b kJ·mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1);
△H=+b kJ·mol
6.在一定温度和压强下,合成氨反应达到平衡时,下列操作平衡不会发生移动的是
A.恒温、恒压时充入氨气 B.恒温、恒容时充入氮气
C.恒温、恒容时充入氦气 D.恒温、恒压时充入氦气
5.将两金属X、Y用导线连接,同时插入相应的电解质溶液中构成原电池,发现Y电极的质量增加,则可能是下列情况中的
A.X是负极,电解质溶液为CuSO4溶液
B.X是负极,电解质溶液为稀H2SO4溶液
C.X是正极,电解质溶液为CuSO4溶液
D.X是正极,电解质溶液为稀H2SO4溶液
4.已知反应 ①H2(g)+1/2O2(g)=H2O(g) △H1
②1/2N2(g)+O2(g)=NO2(g) △H2
③1/2N2(g)+3/2H2(g)=NH3(g) △H3
那么在相同温度下反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的反应焓变为
A.6△H1+4△H2-4△H3 B.4△H3-6△H1-4△H2
C.△H1+△H2-△H3 D.△H3-△H1-△H2
3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
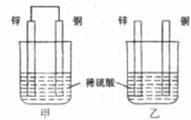
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
2.下列说法中,正确的是
A.在化学反应中,发生物质变化的同时不一定发生能量变化
B.催化剂能改变化学反应的平衡转化率
C.△H的大小与热化学方程式中物质的系数无关
D.反应产物的总焓大于反应物的总焓时,△H>0
1.北京举行的2008年奥运会提出了“科技奥运、人文奥运、绿色奥运”的口号。为了使北京奥运会办成绿色奥运会,下列做法不可取的是
①开发新能源,减少矿物燃料的燃烧 ②关闭所有的化工企业 ③提倡使用一次性发泡塑料餐具和塑料袋 ④开发、生产无汞电池 ⑤机动车安装尾气净化器
A.①②③ B.③④⑤ C.①④ D.②③
29.(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。
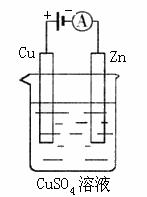
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
28.(10分)有X、Y、Z三种元素,已知:① X2-、Y- 均与Y的气态氢化物分子具有相同的电子数;② Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是 ;
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 ,此液体具有的性质是 (填写字母序号)。
a. 光束通过该溶液时形成光亮的通路
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼热后,有氧化物生成。
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
① 已知一定条件下,每1mol该气体被O2氧化放热98.0KJ。若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4KJ,则该气体的转化率为 。
② 原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com