
25.(10分)将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
Ⅰ、取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1g;
Ⅱ、另取50.0mL混合溶液,向其中加入1.40g铁粉,结果铁粉全部溶解但未见固体析出;
Ⅲ、再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积 换算成标准状况时为0.448L;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度(反应过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前提下,还可测出哪些数据,必须进行哪些实验?
24.(8分)已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO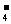 +C2O
+C2O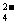 +H+→Mn2++CO2↑+H2O(未配平) MnO2+C2O
+H+→Mn2++CO2↑+H2O(未配平) MnO2+C2O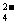 +4H+→Mn2++2CO2↑+2H2O某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠晶体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中定容;从中取出25.00 mL待测液置于锥形瓶中,再用0.0200 mol/L KMnO4标准溶液进行滴定,当滴入20.00 mL KMnO4溶液时恰好完全反应。
+4H+→Mn2++2CO2↑+2H2O某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠晶体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中定容;从中取出25.00 mL待测液置于锥形瓶中,再用0.0200 mol/L KMnO4标准溶液进行滴定,当滴入20.00 mL KMnO4溶液时恰好完全反应。
试填空以下问题:
(1)配平: MnO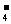 +
C2O
+
C2O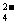 +
H+→ Mn2++ CO2↑+ H2O
+
H+→ Mn2++ CO2↑+ H2O
(2)0.0200 mol/L KMnO4标准溶液应置于下图中的 (填“甲”或“乙”)滴定管中;此实验判断滴定终点的方法是 。
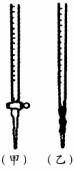
(3)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是 ,若该数据的数值为250.0,求该软锰矿中二氧化锰的质量分数。
23.(10分)乙基香草醛(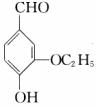 )是食品添加剂的增香原料,其香味比香草醛更 加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更 加浓郁。
(1)写出乙基香草醛分子中两种含氧官能团的名称: 。
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
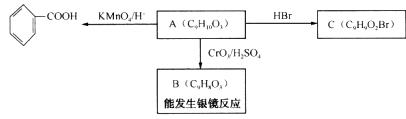
提示:①RCH2OH 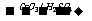 RCHO
RCHO
②与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
(A)由A→C的反应属于 (填反应类型)。
(B)写出A的结构简式: 。
(3)乙基香草醛的一种同分异构体D(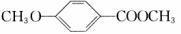 )是一种医药中间体。请设计合理方案用茴香醛(
)是一种医药中间体。请设计合理方案用茴香醛(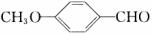 )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
例如:
。
22.(8分)杨梅酯是制作冰制食品、糖果等的香料,可用A、E两种烃为原料,经图所示路线合成。
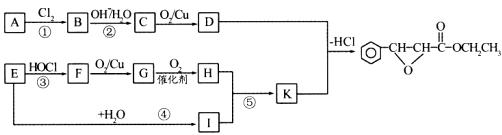
试回答下列问题
(1)写出结构简式:D ,F 。
(2)上述属于取代反应的有 (选填序号)。
(3)写出反应⑤的化学方程式: 。
21.(10分)中央电视台每晚《晚间新闻》之后,都要预报42个重点城市的空气质量,预报中一般是将这些城市空气中的SO2含量和可吸入颗粒的含量(可用g·cm一3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原反应。
假如给你一个气体流速管(单位体积内通过气体的体积恒定,且无除尘和吸收气体作用),请你设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知SO2气体与酸性高锰酸钾溶液反应时,MnO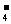 被还原为Mn2+,SO2被氧化为SO
被还原为Mn2+,SO2被氧化为SO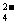 。
。
现有药品:0.1mol/L的酸性KMnO4溶液,颗粒吸附剂,品红试液,pH试纸。
现有仪器:密闭容器用“ ”表示,敞口仪器用“
”表示,敞口仪器用“ ”表示,导管用“ ”或“
”表示,导管用“ ”或“ ”表示.气体流速管用“
”表示.气体流速管用“ ”表示。
”表示。
(1)配制200mL0.1mol/L的酸性KMnO4溶液,需用到的仪器有 、 、
、 等,玻璃棒的作用是 、 。
(2)画出测定空气中SO2和可吸入颗粒含量的实验装置图(并指出仪器中的药品)。
(3)若气体流速管中气体流速为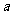 cm3·min
cm3·min ,当t min时,200mL0.1mol/L的酸性KMnO4溶液恰好褪色,求空气中SO2的含量(g·cm
,当t min时,200mL0.1mol/L的酸性KMnO4溶液恰好褪色,求空气中SO2的含量(g·cm )。
)。
(4)若要测定空气中可吸人颗粒的含量,需要测出的数据有
。
空气中SO2的含量还可用检测管测定,其原理是与指示剂KIO3发生作用,可能发生的反应(未配平)有①KIO3+SO2+H2O==I2+H2SO4+KHSO4 ②KIO3+SO2+H2O→+KI+H2SO4
(5)检气管是按上述两个化学方程式中的 方程式设计的,如果是按另一个方程式设计实验程序,能检测空气中的SO2的含量吗? (填“能”或“不能”)。
(6)若用KIO3溶液来吸收SO2,为了能够准确地测定空气中的SO2的含量,拉动采样器的手柄时应该注意 ,理由是
。
20.(10分)已知C、D、F、I均为常见气体,E为常见金属,G溶液蒸于并灼热得红棕色粉末H,I是一种能导致温室效应的气体,B由三种元素组成。它们有如图所示的关系:
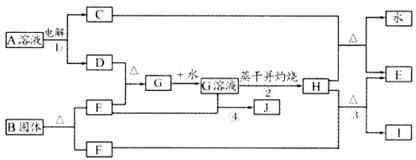
试回答下列问题
(1)反应①阳极的电极反应式: 。
(2)反应③的化学方程式: 。
(3)反应④的离子方程式: 。
(4)反应②蒸发至干并灼烧最终得H而不是无水的G,试用文字和方程式简述其理由:
。
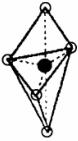
(5)已知B的结构为三角双锥(见图),图中○代表F分子,●代表E原子,写出B的化学式 。
19.(8分)科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以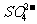 和N4H
和N4H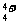 两种形式存在,植物的根系极易吸收N4H
两种形式存在,植物的根系极易吸收N4H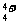 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4不能被植物吸收。请回答下列问题:
,但它遇到碱时,会生成一种形似白磷的N4分子,N4不能被植物吸收。请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)。
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)与草木灰混合使用。
(3)已知白磷、NH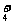 、N4H
、N4H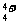 的空间构型均为四面体,NH
的空间构型均为四面体,NH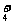 的结构为:
的结构为: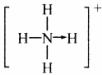 (→表示共用电子对由N原子单方面提供),白磷(P4)的结构为
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构为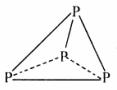 请画出N4H
请画出N4H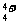 的结构式:
。
的结构式:
。
(4)已知液氨中存在着平衡:2NH3 NH
NH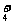 +NH
+NH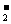 .科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH
.科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH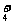 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
。
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
。
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强酸或者强碱时,溶液的pH几乎不变,这可由下列离子方程式来说明,加酸时:NH3·H2O+H+==NH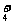 +H2O 加碱时:NH
+H2O 加碱时:NH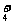 +OH
+OH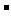 ==NH3·H2O 由于(NH4)2SO4和NH3·H2O的大量存在.加少量酸或碱时,溶液中c(H+)与c(OH
==NH3·H2O 由于(NH4)2SO4和NH3·H2O的大量存在.加少量酸或碱时,溶液中c(H+)与c(OH )基本保持不变;含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或者强碱时发生的离子反应方程式:
)基本保持不变;含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或者强碱时发生的离子反应方程式:
加酸时: ;
加碱时: 。
18.(12分)某校研究性学习小组设计实验测定电石样品的纯度。
查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是H2S+CuSO4==CuS ↓+H2SO4;19PH3+56CuSO4+44H2O==11H3PO4+56H2SO4+32Cu↓+8Cu3P↓。
相关仪器和药品装置图如图所示。
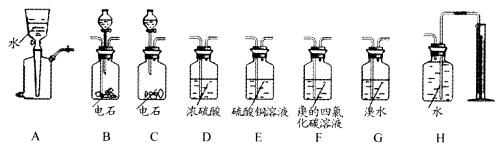
请你参与活动并就下列问题发表你的见解:
(1)按气体从左到右的流向选择合理的装置组合是(选填字母序号): 。
(2)经小组同学讨论认为乙炔的吸收装置选用F装置最佳,理由是:
。
(3)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体 是 。
(4)若电石样品的质量为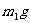 ,F吸收乙炔前后的质量差为
,F吸收乙炔前后的质量差为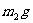 ,则电石样品中CaC2质量分数
,则电石样品中CaC2质量分数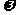 (CaC2)=
。
(CaC2)=
。
17.(10分)某化学课外兴趣小组对教材中铁与水蒸气反应的装置(如下左图)进行了改进(如下右图),并对其产生的气体进行检验。请回答下列问题:
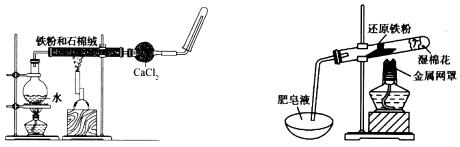
(1)写出铁与水蒸气反应的化学方程式,并标出电子转移方向和数目:
。
(2)右图中湿棉花的作用是 。
(3)改进后的实验与改进前相比,主要的优点有 (至少写出3点)。
(4)右图实验中气体产物的检验方法为 。
16.下图是反应A2+B2 2AB在不同温度和压强下,AB体积分数(AB%)的变化情况。其中a、b曲线为相同压强、不同温度时的变化情况,c曲线在保持与b相同温度时从时间t3开始增大压强的情况。下列叙述正确的是
2AB在不同温度和压强下,AB体积分数(AB%)的变化情况。其中a、b曲线为相同压强、不同温度时的变化情况,c曲线在保持与b相同温度时从时间t3开始增大压强的情况。下列叙述正确的是
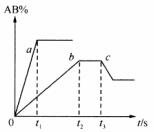
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中只有一种为非气体,正反应吸热
D.从时间t3开始到重新达到平衡这段时间内,体系内的气体平均摩尔质量一定发生变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com