
21.(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl流程如下:
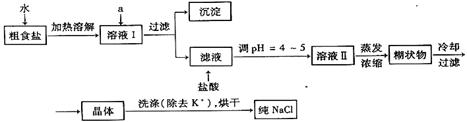
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、CCl4
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
(2)用提纯的NaCl配制500mL4.00mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 2L (填“>”、“=”或“<”),原因是 。
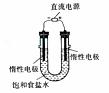
装置改进后,可制备NaOH溶液,若测定溶液中NaOH浓度,常用方法为 。
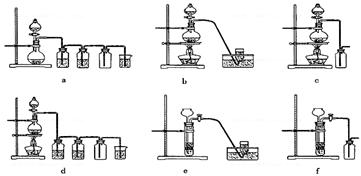
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓)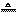 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从上述所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
20.如图所示,下列叙述正确的是
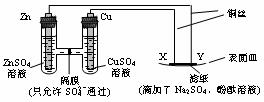
A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有O2生成 D.X与滤纸接触处变红
第Ⅱ卷(非选择题 共60分)
19.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成1 mol硝酸锌时,参加反应的硝酸的物质的量是
A.1 mol B.1.5 mol C.2 mol D.2.5 mol
18.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
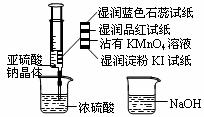
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性强于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性
17.可逆反应2SO2(g)+O2(g)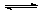 2SO3(g);△H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法正确的是
2SO3(g);△H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法正确的是
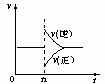
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
16.醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关0.1mol·L-1醋酸钡溶液中粒子浓度的比较错误的是
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
15.CO(g)+H2O(g) CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2和K1的单位均为mol/L B.K2<K1
C.c2(CO)<c2(H2O) D.c1(CO)>c2(CO)
14.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应一定自发进行的是
A.CaCO3(s)=CaO(s)+CO2(g) △H>0
B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g) △H<0
D.2O3(g)=3O2(g) △H<0
13.绿色化学又称环境无害化学,它的着眼点是使污染消灭在生产源头,使整个生产过程对环境友好。分析下列叙述符合绿色化学的是
①从源头制止污染,而不是在末端治理污染;
②只使用生物制品(如用生物发酵法制乙醇),完全取代石油化工原料;
③设计具有高使用效益低环境毒性的化学产品;
④大量用聚苯乙烯等塑料代替木材生产包装盒、快餐盒等,以减少木材使用,保护森林;
⑤研制新的杀虫剂,使它只对目标昆虫有毒杀作用,并能通过生物降解变为无害物质;
⑥合成方法不必具备“原子经济性”原则,即不必使参加反应过程的原子都进入最终产物。
A.①②④⑥ B.①③⑤ C.①②③⑥ D.①③⑤⑥
12.下列离子方程式正确的是
A.盐酸除铁锈: 2H+ + FeO = Fe2+ + H2O
B.醋酸除水垢: 2CH3COO- + 2H+ + CaCO3 = (CH3COO)2Ca + CO2↑+ H2O
C.少量Ba(HCO3)2溶液与NaOH溶液反应:
Ba2++2HCO3-+2OH-=BaCO3↓+2H2O+CO32-
D.苯酚钠溶液中通入少量的CO2:C6H5O-+ CO2 + H2O → C6H5OH + CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com