
25.在体积不变的密闭容器内,N2、H2合成氨反应达到平衡时,容器内有0.15molN2、0.45mol H2、0.35mol NH3。相同条件下,若向该容器中再充入0.15molN2、0.45molH2、0.35mol NH3,则下列叙述正确的是 ( )
A.正、逆反应速率同时增大,平衡时密度减小
B.正反应速率增加倍数等于逆反应速率增加倍数,NH3的体积百分含量不变
C.逆反应速率增加倍数大于正反应速率增加倍数,N2的转化率降低
D.重新平衡时N2<0.3mol,NH3>0.7mol
第Ⅱ卷(非选择题 共35分)
24.AgNO3固体在加热条件下发生下列分解:2AgNO3 2Ag+2NO2↑+O2↑ 则加热0.02mol
2Ag+2NO2↑+O2↑ 则加热0.02mol
的AgNO3固体至完全分解,用排水集气法将收集到标况下的气体体积为 ( )
A.112ml B.672ml C.224ml D.298ml
23.现有反应X(g) + Y(g)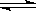 2Z(g)(正反应为放热反应),下图表示从反应开始到t1秒时达到平衡,在t2秒时由于条件变化使平衡破坏,到t3秒时又达平衡。则在图中t2秒时改变的条件可能是 ( )
2Z(g)(正反应为放热反应),下图表示从反应开始到t1秒时达到平衡,在t2秒时由于条件变化使平衡破坏,到t3秒时又达平衡。则在图中t2秒时改变的条件可能是 ( )
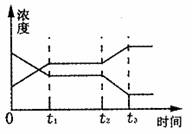
A.降低温度
B.使用了催化剂
C.增大压强
D.减小了X或Y的浓度
22.据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是 ( )
A.正极反应式为:O2+2H2O+4e- ===4OH-
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.氢氧燃料电池可将热能直接转变为电能
21.下列溶液中有关物质的量浓度关系一定正确的是 ( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(M+) == c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-) == 2c(H+)+ c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
20.在等温等容条件下有下列气体反应:2A(g)+2B(g)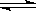 C(g)+3D(g),现分别从两条途径建立平衡:I:A和B的起始浓度均为2mol/L; II:C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
C(g)+3D(g),现分别从两条途径建立平衡:I:A和B的起始浓度均为2mol/L; II:C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
A.最终达到平衡时,两个途径所得混合物平均相对分子质量不相同
B.最终达平衡时,体系内同一气体的体积分数相同
C.最终达平衡时,体系内同一气体的浓度相同
D.最终达平衡时,两个途径的反应速率相同
19.有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:
8Li+3SOCl2=6LiCl+Li2SO3+2S。
下列有关叙述中,正确的是 ( )
A.金属锂作电池的正极,石墨作电池的负极
B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
18.下列事实能说明醋酸是弱电解质的是 ( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0.1 mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍
A.②⑥⑦⑧ B.③④⑥⑦ C.③④⑥⑧ D.①②
17.反应3A(g)+B(s) 2C(s)+3D(g)+6E(g),△H>0,图象表示温度、压强与该反应中某个量X的关系,下列叙述正确的是 ( )
2C(s)+3D(g)+6E(g),△H>0,图象表示温度、压强与该反应中某个量X的关系,下列叙述正确的是 ( )
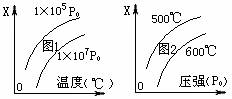
A.图1中的X只能是D的体积百分含量
B.图2中的X可能是A的浓度或体积百分含量
C.图1中的X可能是C的浓度
D.图2中的X可能是D或E的体积百分含量
16.常温下,将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合液的pH等于11时,强酸与强碱溶液的体积比是: ( )
A.10∶1 B.1∶9 C.9∶2 D.9∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com