
19.(10分)过度排放CO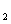 会造成“温室效应”,科学家正在研究如何将CO
会造成“温室效应”,科学家正在研究如何将CO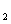 转化为可以利用的资源,其中一种方案就是将CO
转化为可以利用的资源,其中一种方案就是将CO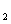 转化为可再生燃料甲醇(CH
转化为可再生燃料甲醇(CH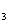 OH)。其化学方程式为:
OH)。其化学方程式为:
CO2(g)+3H2(g)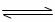 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
请填空:
(1)写出上述反应的平衡常数表达式K:______________________.
(2)在容积为2 L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如下图所示。下列说法正确的是(填序号)___________。
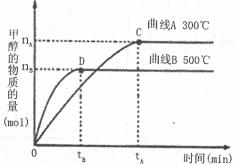
A.在300℃,从反应开始到平衡,甲醇的平均反应速率
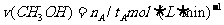
B.反应体系从300℃升温到500℃,平衡常数K变大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升温到500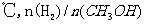 增大
增大
(3)25℃,1.01×10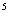 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是________________正极的电极方程式为_________________________.
选考卷
本卷2题,各13分。考生请在20(A)、20(B)中任选一题作答。将所选题的A或B代号在选考题选择栏内的相应字母涂黑,并将答案填写在答题卡选考题的答题区域内。
18.(12分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制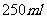
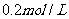 的醋酸溶液,用
的醋酸溶液,用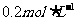 的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250mL 0.2mol·L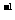 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和______________.
醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和______________.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol 的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为_____________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L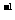 ) ) |
0.0010 |
0.100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_________________________________________________________________________
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案
___________________________________________________________________________
17.(10分)某种施用于沙壤土的化肥主要成分由A、B、C、D四种短周期元素组成,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素的单质在空气中的体积百分含量最高;C与D同主族;D元素原子的最外层电子数是其次外层电子数的3/4。请填空:
(1)A元素的原子结构示意图为__________________________________________
(2)D元素在元素周期表中的位置为________________________________________
(3)C和D两种元素相比较,非金属性较强的是(填元素名称)_______,可以验证该结论的证据是(填序号)__________________。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
(4)A、B、C间可形成甲、乙两种有l0个电子的离子,在加热时它们相互反应可以生成两种含10电子分子的化合物,则甲与乙反应的离子方程式为_______________.
16.(10分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系
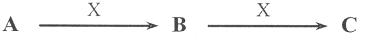
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”。则X的化学式为__________。
(2)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成;C能使湿润的蓝色石蕊试纸变红。则A与C在浓硫酸和加热条件下反应的化学方程式为___________________________________________________.
(3)若A、B、C的焰色反应均为黄色,A是一种工业原料,B俗称小苏打,电解C的水溶液可以得到两种气态产物,这两种气态产物在工业上可以合成X,则电解C的水溶液的离子方程式为__________________________。
(4)若A、C为无色溶液。B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,X的焰色反应为黄色,则C溶液中除氢氧根外还存在的阴离子的化学式为_______.
(5)若A、B、C均为氧化物,X是一种黑色固态非金属单质,则B分子的结构式为______.
15.在一定条件下,将3 molA和1 molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应: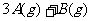

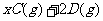 。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L
。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L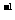 下列判断正确的是 ( )
下列判断正确的是 ( )
A.平衡常数约为0.3
B.B的转化率为60%
C.A的平均反应速率为0.3mol·(L·min)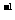
D.若混合气体的密度不变则表明该反应达到平衡状态
第Ⅱ卷 (本卷4题。共42分)
14.奥运会上发令枪所用“火药’’的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:
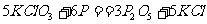 。下列有关该反应的叙述,正确的是 ( )
。下列有关该反应的叙述,正确的是 ( )
A.反应中红磷是氧化剂
B.发令时产生的白烟只有KCl固体颗粒
C.“火药”中的红磷可用白磷代替
D.反应中消耗3 mol P时,转移电子的物质的量为15 mol
13.下列说法错误的是 ( )
A.可用水鉴别苯、四氯化碳、乙醇三种无色液体
B.取1 g NaOH固体于烧杯,加入9 mL水(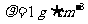 )充分搅拌配成10%的NaOH溶液
)充分搅拌配成10%的NaOH溶液
C.用NaOH溶液就可鉴别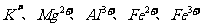 五种离子
五种离子
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
12.下列事实得出的结论正确的是 ( )
A.用一束强光照射经过煮沸的三氯化铁溶液有光的通路,说明已生成氢氧化铁胶体
B.某雨水样品放置一段时间,pH由5.6变为4.3,说明水中溶解了更多的CO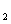
C.常温下铜可溶于浓硝酸,铁不溶于浓硝酸,说明铜比铁更活泼
|
11.下列叙述正确的是 ( )
A.随着化学的发展,化学实验方法并不是化学研究的唯一手段
B.研究质子和中子的结构是化学科学研究的一项新任务
C.根据盖斯定律,燃烧一定量的煤和燃烧同量的煤干馏后的焦炭产生的热量一样多
D.在通风橱进行有毒气体的实验是一种符合“绿色化学”思想的防污染手段
10.分类是学习和研究化学的一种常用的科学方法。下列分类正确的是 ( )
①根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A.①②③ B.①②⑤ C.①②④ D.③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com