
7.设NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.23gNO2和23gN2O4所含原子数目均为1.5NA
B.18gD2O所含电子数目为10NA
C.标准状况下,22.4L乙醇所含分子数目为NA
D.1Lmol·L-1的两种强酸溶液中,所含氢离子数目均为NA
6.在理论上不能用于设计原电池的化学反应是 ( )
A.Al(OH)3(s)+NaOH(aq)===NaAl(OH)4(aq);△H<0
B.CH3CH2OH(l)+3O2(g)→2CO2(g)+3H2O(l);△H<0
C.CO2(g)+C(g)===2CO(g);△H>0
D.H2(g)+Cl2(g)===2HCl(g);△H<0
5.下列叙述中一定能判断某化学平衡发生移动的是 ( )
A.混合物中各组分的浓度改变 B.正、逆反应速率改变
C.混合物中各组分的含量改变 D.混合体系的压强发生改变
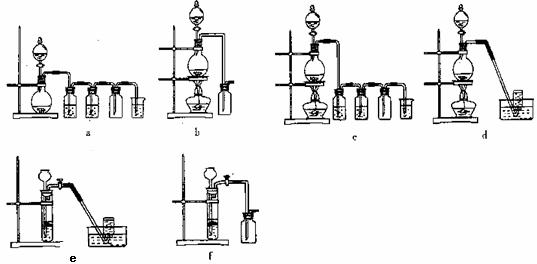
4.下列装置或操作能达到实验目的的是 ( )
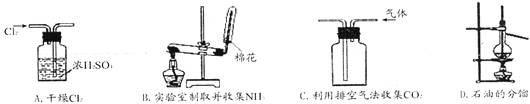
3.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②天然气和石油都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是 ( )
A.①②③④ B.①②⑤⑥ C.①③④⑦ D.③⑤⑥⑦
2.下列叙述正确的是 ( )
A.△H>0的化学反应一定不能自发进行
B.反应2NO2(g)→N2O4(l)的熵(体系混乱度)增大(即△S>0)
C.环境保护的根本是研究怎样将污染物质转化为有用物质
D.使用含氟牙膏可以预防龋齿
1.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(g);△H=571.6kJ·mol-1
B.明矾水解的离子方程式:Al3++3H2O
 Al(OH)3+3H+
Al(OH)3+3H+
C.NaOH(aq)与NaHCO3(aq)反应离子方程式:HCO-3+OH-===CO32-+H2O
D.钢铁电化腐蚀时,负极反应为:Fe-2e-=Fe2+
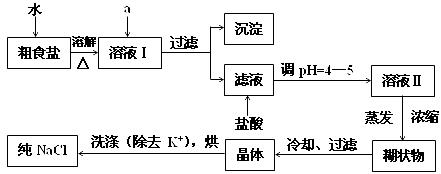
27.(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2
溶液,75%乙醇,四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为____________________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_______________________。
(2)用提纯的NaCl配制500mL 4.00 mol·L-1的NaCl溶液,所用仪器除药匙、玻璃棒外
|
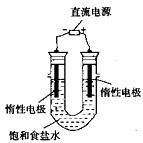
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2______(填“>”“=”或“<”)2L,原因是_________________________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为____________________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn + H2SO4===ZnSO4 + H2↑;
MnO2 + 4HCl(浓)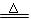 MnCl2
+ Cl2↑+ 2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
MnCl2
+ Cl2↑+ 2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:
选考题(每科选做1题)
26.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)===CH4(g)+ HC≡CH(g)+ H2(g) H1= +156.6 kJ·mol-1
H1= +156.6 kJ·mol-1
CH3CH=CH2(g)===CH4(g)+ HC≡CH(g) H2= +32.4 kJ·mol-1
H2= +32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===CH3CH=CH2(g)+ H2(g)的 H=_______kJ·mol-1
H=_______kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3- + H+的平衡常数K1=_________。(已知:10-5.60=2.5×10-6)
HCO3- + H+的平衡常数K1=_________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)(填“>”“=”或“<”),原因是____________________(用离子方程式和必要的文字说明)。
25.(15分)以下框图中A-M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
请回答下列问题:
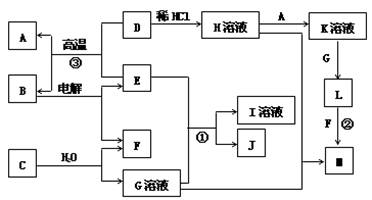
(1)写出B的化学式_________;指出C物质中所包含的化学键类型________________。
(2)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式___________。
(3)写出①反应的离子方程式__________________________________。
(4)写出②、③反应的化学方程式_______________________________________;
___________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com