
29.(15分)阿司匹林具有解热镇痛效果,其结构简式为
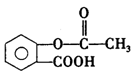 。
。
(1)阿司匹林分子中存在羧基和酯基等官能团。人们在检验有效成分为有机物的药物时,常通过分析有机物的官能团来检验和判断药物的药性和药效。
①可用________________来检验羧基的存在,能观察到的现象是___________。
②酯基无法直接检验。为检验阿司匹林中的酯基,可以使其在酸性条件下水解,通过检验水解产物中的酚羟基来证明该酯基的存在。阿司匹林在酸性条件下水解的化学方程式为____________________。检验水解产物时可以滴入_________________,若观察到__________________现象,证明存在酚羟基。
(2)阿司匹林分子发生水解后,所得产物能电离出H+的官能团总数是原来的_________
倍,因此增大了对胃肠道的刺激。可以用 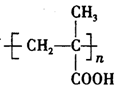 和乙二醇制备缓释阿司匹林
和乙二醇制备缓释阿司匹林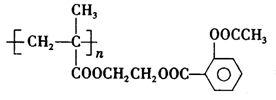 ,该反应的化学方程式为_____________。
,该反应的化学方程式为_____________。
(3)阿司匹林有多种同分异构体,其中不与金属钠反应,且苯环上的一氯代物只有两种的同分异构体的结构简式为(写出一种即可)__________________________。
(4)复方阿司匹林主要含有阿司匹林、非那西汀和咖啡因三种成分。已知:
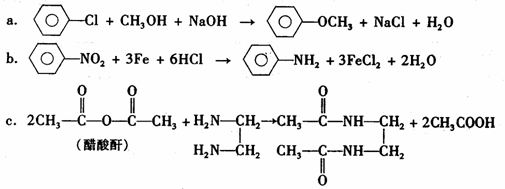
利用如下反应可合成非那西汀(部分反应条件未注明)
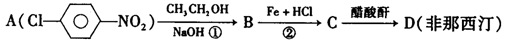
写出反应①、②所属的反应类型:①__________________;②__________________。
D的结构简式是______________________________________________.
28.(13分)某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如下图所示。同学们根据中学化学知识,对该试剂的成分进行了一系列 猜想和探究。

(1)同学们首先排除了试剂的成分是硫酸铜、硫酸铁、硫酸亚铁等的可能,理由是
______________________________________。
(2)取出少量溶液置于试管中,向其中滴入石蕊试液,石蕊试液呈现红色,同学们认为可以排除硫酸钠、硫酸钾等,理由是___________________________;但是不能排除是硫酸铵的可能性,其原因是(用离子方程式表示)_________________。
(3)向试管中加入锌粒,有大量无色气泡快速冒出。根据此现象,可推测溶质可能是下列物质中的___________________(填字母代号),生成气体的有关反应的离子方程式为_________________________.
A.NaHSO4 B.KHSO4 C.MgSO4 D.H2SO4
E.Al2 (SO4)3 F.(NH4)2SO4
(4)假设真正的溶质就在上述六种物质之中,请在上述探究结果的基础上,设计一个定量实验方案对试剂的成分加以确定_________________________________
_______________________________________________________________。
27.(18分)根据以下各物质间的转化关系回答有关问题。
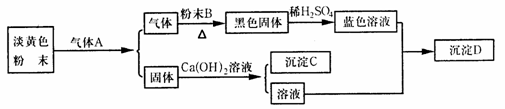
(1)B、C、D的化学式依次为_____________、___________、____________。
(2)A的电子式为_______,它属于____________(填“极性”或“非极性”)分子。
(3)淡黄色粉末与气体A反应的化学方程式为___________________________;黑色固体与稀硫酸反应的离子方程式为__________________。
(4)下图为中学化学实验室常用的部分装置或仪器,请填写有关空白。
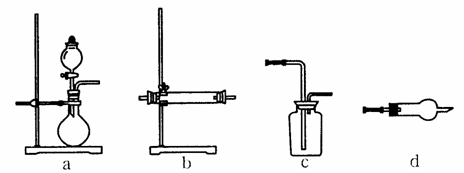
①淡黄色粉末与气体A的反应,可以选择在上述装置___________(填字母代号,下同)中进行;气体与粉末B的反应可选用上述装置中的____________作反应发生装置。
②实验室通常用沉淀C和_______________反应制取气体A;制取时的反应装置应选用上述装置中的_____________________;若要用浓硫酸干燥制得的气体A,应选用上述装置中的__________作干燥装置。
③请写出装置d在中学化学实验中的可能用途(写出两条即可)________________
26.(14分)黄铜矿(主要成分为CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的有关反应为:8CuFeS2+21O2===8Cu+4FeO+2Fe2O3+16SO2。
已知在CuFeS2中Fe的化合价为+2,则该冶炼铜的反应中被氧化的元素是________(填元素符号)。
(2)上述冶炼过程中会产生大量SO2。下列处理方案中不合理的是_______(填字母代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制取Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2,有关离子方程式为:
S2O2-8+2I-===2SO2-4+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。Fe3+对上述反应的催化过程(Fe3+参与反应)用离子方程式可表示为
_____________________、____________________.
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:a.用稀盐酸浸取炉渣,过滤.b.滤液先经过氧化,再加入过量的NaOH溶液,反应后过滤;c.将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
①b中除去Al3+的有关反应的离子方程式为_________________________。
②2.3g黄铜矿(含CuFeS280%)理论上可制得Fe2O3_________________g。
13.在铁粉和铜粉的均匀混合物中加入某浓度的硝酸,充分反应,硝酸的还原产物只有NO。当加入硝酸10 mL时,剩余金属1.8 g,生成气体0.224 L;再增加硝酸10mL时,剩余金属0.96 g,又有0.224 L气体生成;继续增加硝酸10 mL时,金属全部溶解,又有0.224L气体生成(以上体积均换算为标准状况下)。下列说法不正确的是 ( )
A.所加入硝酸的浓度是4 mol/L
B.加入硝酸l0 mL时,剩余金属为铁和铜
C.共加入硝酸20 mL时,剩余金属只有铜
D.如果在金属混合物中共加入硝酸40 mL时,生成的NO仍是0.672 L(标准状况)
第Ⅱ卷
本卷共10题,共174分。
12.下列有关水的电解实验的说法中不正确的是 ( )
A.为提高水的电解速率,可以在水中加入少量的氯化钠
B.若在水中加入少量的硫酸钠,电解结束后溶液的pH将会保持不变
C.电解过程中,阴极区附近的溶液会使酚酞试液变红
D.当电解产生氧气1.12 L(标准状况)时,转移的电子总数为0.2mol
11.某化学学习小组探究在其他条件不变时,改变某一条件对化学平衡的影响,得到的变化规律如下图所示(图中P表示压强,T表示温度,n表示物质的量,v表示反应速率)。由此可判断下列结论不正确的是 ( )
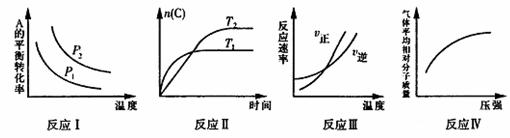
A.若反应I为2A(g)+B(g) 2C(g),则△H<0,P2>P1
2C(g),则△H<0,P2>P1
B.若反应II为2A(g) C(g),则△H<0,T1>T2
C(g),则△H<0,T1>T2
C.若反应III为2A(g)+B(g) 3C(g),,则△H>0
3C(g),,则△H>0
D.若反应IV可能是:A(g)+B(g) 2C(g)+D(s)
2C(g)+D(s)
10.用氨气作喷泉实验的装置如下图所示,该实验有三个主要的操作:a.快速挤压胶头滴管;b.打开开关;c.把导管放入到烧杯的水面下。按照下列操作顺序进行实验肯定不能产生喷泉现象的是 ( )
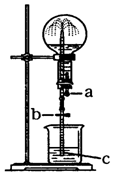
A.c b a B.b c a C.c a b D.b a c
9.短周期元素X和Y可形成化合物XY3。下列有关说法正确的是 ( )
A.若X的原子序数为m,则Y的必为m-4
B.XY3的晶体一定是离子晶体
C.X与Y可能属于同一周期,也可能分属于不同周期
D.X的原子半径一定大于Y的原子半径
8.下列离子方程式的书写正确的是 ( )
A.在氢氧化钠溶液中通入少量二氧化硫:SO2+OH-==HSO-3
B.在碳酸氢钠溶液中加入足量氢氧化钡溶液:HCO-3+Ba2++OH-==BaCO3↓+H2O
C.将盐酸滴入氨水中:H++OH-==H2O
D.将铝片加入到浓烧碱溶液中:Al+2OH-==AlO-2+H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com