
10.下列各组离子在指定溶液中可能大量共存的是 ( )
①无色溶液中:K+、Cu2+、Na+、MnO4-、SO42-
②水电离产生的c(H+)=1×10-12mol·L-1的溶液中:Mg2+、SO42-、NO3-、Cl-
③加入Al能放出H2的溶液中:HCO3-、Na+、NO3-、Cl-
④能使pH试纸变为蓝色的溶液中:S2-、Na+、SO32-、Cl-
⑤含有大量Fe3+的溶液中:K+、Na+、AlO2-、SO42-
A.②④ B.②③ C.①⑤ D.①④
9.设NA为阿伏加德罗常数,下列说法不正确的是 ( )
A.标准状况下,1.12L氡气(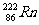 )中含中子数为6.8
NA
)中含中子数为6.8
NA
B.6.02×1023个CnH2n+2分子中含有共价键数为(3n+1)NA

C.7.8g Na2O2与足量CO2反应,转移电子数为0.1
NA 
D.0.1mol/L的100mL H2SO3溶液中,含有的离子数约为0.03 NA
8. 沈城“巨能钙”事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。下列有关说法错误的是 ( )
A.双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
B.H2O2、Na2O2中都存在非极性共价键
C.H2O2既有氧化性,又有还原性,与KMnO4反应时表现H2O2的还原性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,和SO2不同
7.下列各组物质的分类正确的是 ( )
A.同位素:1H、D+、T2
B.电解质:H2O、CH3COOH、NH4HCO3
C.胶体:饱和氯化铁溶液、淀粉溶液、牛奶
D.硅酸盐产品:晶体硅、水泥、陶瓷
29.(10)依据氧化还原反应Zn(s)+2H+(aq)=Zn2+(aq)+H2(g)设计的原电池如图所示:(开始X棒和铜棒均重19.20g):
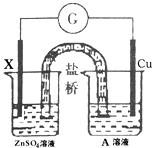
(1)X电极和A溶液分别为 ( )
A.Cu和ZnSO4 B.Zn和H2SO4 C.Zn和CuSO4 D.Zn和ZnSO4
(2)若用该原电池作为电源,用惰性电极电解醋酸钾溶液,可得到乙烷,
发生的反应为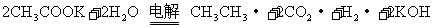 ,则与铜极相连的惰性电极上发生的电极反应式为
,则与铜极相连的惰性电极上发生的电极反应式为
(3)电解一段时间后,取出铜棒洗净,放入100 mL 12.0 mol/L的浓HNO3中充分反应,共收集到一氧化氮和二氧化氮气体8.96L,若用排水法收集该气体可以得到气体 升(气体体积均在标准状况下测定的)。
(4)室温时,向(3)反应后的溶液中加入 mol NaOH固体,充分反应后得到pH=4.5的溶液(精确到小数点后两位数字,整个反应过程中,溶液体积的变化忽略不计,室温时,Cu(OH)2的溶度积KSP=2.0×10-20)。
28.(18分)芳香族化合物A(化学式为C9H12NBrO2)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应也能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。
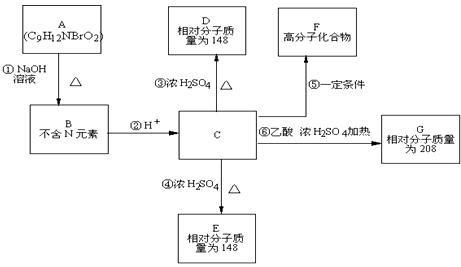
(1)写出A、E、G的结构简式A E G
(2)反应③的化学方程式:
已知R物质属于C的同分异构体,其性质如下:
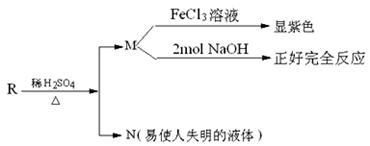
(3)若R的苯环上一卤代物有两种,R的结构简式为
(4)若R的苯环上一卤代物有三种,R的结构简式 (任写一种)
27.(14分)某校化学课外活动小组,制取NaHCO3溶液,并研究饱和NaHCO3溶液的性质:
I:NaHCO3溶液的制取:
药品:(1)2%NaOH溶液 (2)稀HCl溶液 (3)稀H2SO4溶液
(4)饱和KHCO3溶液 (5)浓H2SO4 (6)CaCO3固体 (7)K2CO3粉末
仪器装置(如图所示):
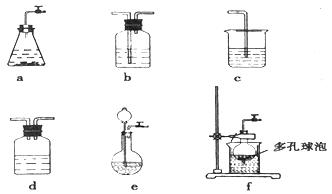
请按下表要求,填写选择的装置和药品
|
分项 内 容 |
CO2发生装置(X)随开随用,随关随停 |
除杂洗气装置(Y) |
制备产品装置(Z) |
|
选择的装置(填序号) |
|
|
c |
|
选择的药品(填序号) |
|
|
|
Ⅱ:从10℃时加热NaHCO3饱和溶液,测得溶液的pH发生如下变化。
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
(1)NaHCO3溶液呈碱性是由于 。
(2)甲同学认为:溶液pH升高的原因是由于温度升高HCO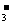 的水解程度增大。
的水解程度增大。
乙同学认为:溶液pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
丙同学认为甲、乙的判断都不充分,丙认为:
①只要在加热煮沸的溶液中加入适量的试剂X,若能产生沉淀,则乙同学的判断正确,试剂X是
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH 8.3 (填“高于”“低于”或“等于”) 则甲同学的判断正确。
③查阅资料发现,NaHCO3的分解温度为150℃,丙断言 同学判断是错误的,理由是
。
26.(16分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是
(填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)由A、C两种元素形成的离子化合物中C元素的质量分数为73.68%,它的所有原子最外层都符合相应的稀有气体原子的最外层电子层结构,该物质加热时就能分解为两种气体,则X的化学式为 ,X受热分解的化学方程式为_____________________。
(3)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,与Y的阴离子具有相同原子数和电子数的分子有 (任写一种),Y与盐酸反应的离子方程式为 。
(4)(CA4)2SO4溶液加水稀释时,溶液中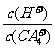 的值将 (填“增大”、“减少”或“不变”)。
的值将 (填“增大”、“减少”或“不变”)。
13.已知①2C(s)+O2(g)=2CO(g);ΔH=-221.0kJ/mol ②2H2(g)+O2(g)=2H2O(g);ΔH=-483.6kJ/mol。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g);ΔH为 ( )
A.+262.6kJ/mo1 B.-131.3kJ/mol C.-352.3kJ/mol D.+131.3kJ/mol
非选择题
12.下列各项中的两个量,其比值一定为2:1的是 ( )
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体
B.在碳与浓硫酸的反应中,还原产物与氧化产物的物质的量
C.1mol Na2O2与1molNa2O中的阴离子数目
D.相同温度下,0.2mol/L醋酸溶液和0.1mol/L醋酸溶液中c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com