
10.化学与社会、生活、环境保护密切相关,下列现象或事实与解释一致的是 ( )
|
编号 |
现象或事实 |
解释 |
|
A |
用热的纯碱溶液洗去油污 |
纯碱可以直接与油污反应 |
|
B |
在农田施肥时,草木灰(主要成分K2CO3)不能与氯化铵混合使用 |
一定条件下,K2CO3与NH4Cl会发生反应,有“跑氨”现象 |
|
C |
漂白粉因在空气中放置时间过久而变质 |
漂白粉中的CaCl2与空气中的CO2反应生成碳酸钙 |
|
D |
利用氯化铁溶液可以制作铜质印刷线路板 |
FeCl3溶液置换出铜单质 |
9.下列溶液中各种离子能够共存,且加入铝粉无气体产生的是 ( )
A.H+、Cl-、Na+、Mg2+ B.CH3COO-、SO32-、K+、Ca2+
C.OH-、NO3-、Ba2+、Ag+ D.SO42-、Br-、Mg2+、K+
8.根据化学平衡知识,判断下列说法正确的是 ( )
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.向AgCl悬浊液中加入足量的NaI溶液,无明显现象产生
D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
7.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.33.6 L氯气与27 g铝充分反应,转移的电子数一定为3NA
B.用0.2 mol Cl2溶解于10 L的水中,可生成0.2 NA个HClO
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.0.012 kg 13C中,含碳原子数为NA
6.根据有机化学相关知识,判断下列说法错误的是 ( )
A.C2H4在一定条件下与水反应可得到C2H5OH
B.苯能与溴的四氯化碳溶液反应并褪色
C.淀粉和纤维素都是高分子化合物,在一定条件下水解能生成葡萄糖
D.用激光笔照射鸡蛋白质溶液,在垂直于光线的方向可观察到光亮通路
29.(15分)已知:同一个碳原子上连有两个羟基时不稳定,会自动失水,即
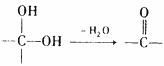 A1、A2、A3、A4是化合物
A1、A2、A3、A4是化合物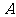 的四种同分异构体,它们的相对分子质量不超过l80,分子中只含碳、氢、氧三种元素,其中氧的质量分数为31.58%。实验表明:A1、A2、A3、A4均是只有一个侧链的芳香族化合物,它们均含有醇羟基,并可以进行如下反应,产物中E、F、G、K均为芳香族化合物。
的四种同分异构体,它们的相对分子质量不超过l80,分子中只含碳、氢、氧三种元素,其中氧的质量分数为31.58%。实验表明:A1、A2、A3、A4均是只有一个侧链的芳香族化合物,它们均含有醇羟基,并可以进行如下反应,产物中E、F、G、K均为芳香族化合物。
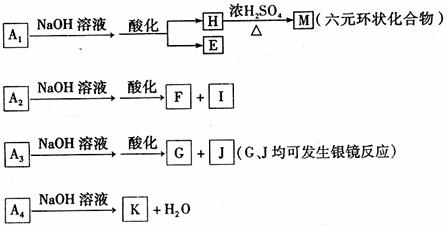
(1)A的相对分子质量为 ,分子式为 。
(2)写出A1、A3,的结构简式。A1: ______;A3: ____。
(3)写出由H生成M的化学反应方程式 ,反应类型为 。
(4)现有如下试剂:稀盐酸、稀硫酸、NaHCO3溶液和FeCl3,溶液。从中选择合适试剂,
简述鉴别E和F溶液的实验操作方法、现象及结论。_______________________
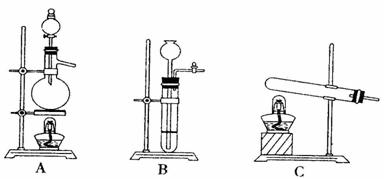
28.(20分)在中学化学实验室中,可通过下图的方法制得一种常见的有毒气体Z。
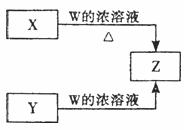
X是黑色粉末,Y是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
(1)写出X与W的浓溶液共热生成Z的离子方程式 。
(2)X与Y混合后共热可产生一种无毒气体,反应的化学方程式为 。
下图是实验室常见的气体发生装置,此反应应选用的发生装置是 (填字母编号)。实验过程中,检验气密性之后(气密性良好),向该装置中加入粉末状固体的操作是: 。
(3)Z与乙烯加成可得一种有机物,为验证该有机物中含有与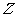 相同的元素,请选择合适的试剂
(用字母编号回答)。
相同的元素,请选择合适的试剂
(用字母编号回答)。
a.稀盐酸 b.稀硝酸 c.稀硫酸 d.氢氧化钠溶液
e.硝酸银溶液 f.淀粉溶液 g.碘化钾溶液 h.品红溶液
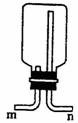
(4)在实验室中制取气体Z时,通常可用排某种溶液的方法收集Z,则该溶液是 ;也可用排空气集气法收Z,若用下图装置(不能改变瓶口朝向),则气体应该从 (填“m””或 “n”)口进。
(5)有人设想利用原电池原理以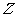 和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z的电极为原电池的 极,其电极反应为
。
和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z的电极为原电池的 极,其电极反应为
。
27.(15分)X、Y、Z、W是周期表中原子序数依次增大的前20号元素。X、Y同周期。Y、Z同主族,Zn-与Wn+离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下A为液体,B、C、E、G为气态化合物,且A、C、G均为直线型分子;D是由元素W、Y形成的常见化合物。
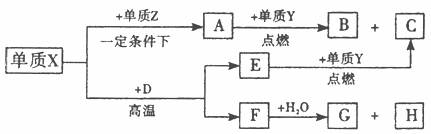
(1)元素W的名称 ,Z的原子结构示意图 ,A的电子式 。
(2)写出D、E的化学式:D. 、E. 。
(3)① 已知38 g A与Y完全反应生成B、C时放出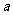 kJ的热量,写出该反应的热化学方程式:
____________;
kJ的热量,写出该反应的热化学方程式:
____________;
② F与水反应的化学方程式: ____________;
26.(10分)作为重要的工业三酸之一,硝酸通常有以下两种制取方法:
Ⅰ.硝酸盐与浓硫酸反应:NaNO3+H2SO4 NaHSO4+HNO3↑
NaHSO4+HNO3↑
Ⅱ.氨的催化氧化法,其主要步骤为:① 氨的催化氧化;② NO氧化成NO2;③ 水吸收NO2生成硝酸。
(1)方法l中不能加强热,其原因是 ______________________________。
(2)写出方法Ⅱ中步骤①的化学反应方程式 ________________________。
(3)采用方法Ⅱ制取硝酸,若经过多次循环后,步骤②、③中氮元素的总利用率是90%,某化工厂用1 t氨气制得5t63%的硝酸溶液,求步骤①中氨气的转化率?(书写计算过程,结果精确到0.1%)
13.以Pt为电极,电解含有0.10mol M+和0.10mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如下图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子) ( )
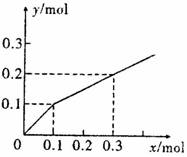
A.M+ > H+ > N3+
B.M+ >N3+ > H+
C.N3+ >H+ > M+
D.条件不足,无法确定
第Ⅱ卷(非选择题,共174分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com