
15.鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。现有鸦片的替代品用于脱瘾治疗,结构如图所示。则lmol该化合物完全燃烧耗O2的物质的量、与NaOH溶液作用消耗NaOH的物质的量以及其苯环上一溴代物的种数分别是 ( )
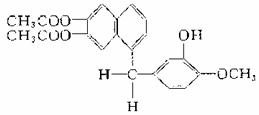
A.26 mol、4 mol、7 B.26 mol、4 mol、8
C.24 mol、5 mol、8 D.24 mol、5 mol、7
14.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/LCH3COONa与6mL lmol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c (H+)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4C1溶液:
c [(NH4)2SO4]<c[(NH2)2CO3]<c(NH4C1)
13.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是 ( )
A.Na+、K+、C1-、OH- B.Na+、Mg2+、S2-、C1O-
C.H+、Na+、SO42-、NO3- D.K+、Ca2+、OH-、SO32-
12.某化学科研小组研究在其他条件不变时,改变某一条件对
A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
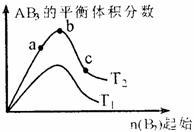
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1:3
11.已知中学化学中常见反应形式为:A+B→C+D+H2O,对于该反应的下列叙述不正确的是 ( )
A.设反应可能是氧化还原反应 B.该反应可能是非氧化还原反应
C.C和D有一种一定是盐 D.A和B不一定是酸或碱
10.设NA表示阿伏加德罗常数的值,下列叙述中一定正确的是 ( )
A.常温常压下乙烯和丁烯混合气a g,其中C-H键的数目约为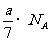
B.1 mol FeCl3制成胶体,所得胶体的粒子数为NA
C.0.5mol/LBa(NO3)2溶液中,NO3-的数目为NA
D.标准状况下,22.4L庚烷中含碳原子数为7NA
9.下列离子方程式表达正确的是 ( )
A.Ca(HCO2)2溶液与足量盐酸混合:Ca(HCO3)2+2H+==Ca2++2CO2↑+2H2O
B.Na2CO3溶液中通入CO2气体:CO32-+CO2+H2O 2HCO3-
C.实验室用NH4Cl固体与Ca(OH)2固体混合制NH3:NH4++OH-
D.将SO2气体通入NaClO溶液中:SO2+2C1O-+H2O SO32-+2HClO
8.下列说法正确的是 ( )
A.二氧化碳分子中存在非极性共价键和分子间作用力
B.甲烷、氨和水都是由极性键结合而成的极性分子
C.同主族不同元素的最高价氧化物,一定具有相同的晶体结构
D.氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点
7.已知NaHSO4在水中电离方程式为:NaHSO4 Na++H++SO42-,某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是 ( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
B.水电离出来的c(OH-)=1×10-10mol·L-1
C.c(H+)=c(OH-)+c(SO42-)
D.该温度高于25℃
6.下图为短周期的一部分,推断关于Y、Z、M的说法正确的是 ( )
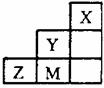
A.非金属性:Y>Z>M
B.ZM2分子各原子均满足8e-稳定结构
C.原子半径:M>Z>Y
D.Y离子的结构示意图可表示为: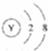
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com