
12.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
2A(?)+ B(?) xC(g) ΔH<0平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是 ( )
xC(g) ΔH<0平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是 ( )
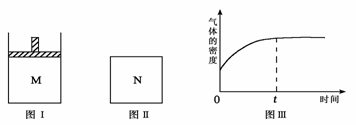
A.x =2
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M中C的物质的量大于N中C的物质的量
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
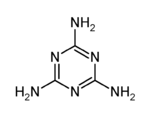
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.4 g重水(D2O)中所含中子数为0.2NA
B.4.48 L H2和O2的混合气体中所含分子数为0.2NA
C.0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA
D.12.6 g三聚氰胺(结构如图)所含碳氮单键的数目为0.6NA
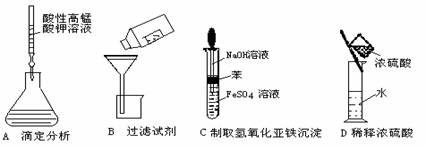
10.下列操作或仪器的选用正确的是 ( )
9.2008 年北京奥运场馆中,国家游泳中心的外墙体可以使用15至20年仍保持完好如初。这是我国第一个采用ETFE[聚氟乙烯(C2H2F2)n]塑料膜作为立面维护建筑体系的材料。下列关于ETFE的判断正确的是 ( )
A.它是易降解的新型塑料,不会形成白色污染
B.它是使常规建筑材料保持整洁美观的保护层
C.它的组成中含有碳分子、氢分子和氟分子
D.它属于天然有机高分子材料
26.铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+,请分析下图回答有关问题:
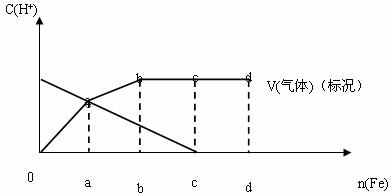
(1)假设有任一气体产生的线段内只有一种还原产物,试配平由b点到c点时反应的化学方程式
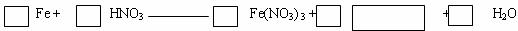
(2)从0点到a点时的还原产物为 。
(3)a点到b点时产生的还原产物应为 ,其原因是 。
(4)已知到达d点时,反应完全结束,此时溶液中的主要阳离子为 ,且分析投入金属铁的物质的量之比为nc(Fe)/ nd(Fe)= 。
25.某校化学小组学生利用下图装置进行“氨的催化氧化及其产物验证”实验。(图中夹持装置已略去)
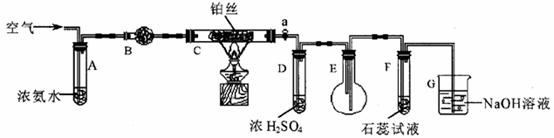
(1)装置B中盛放的试剂是________(填名称),用来吸收混合气体中的汽水。
(2)反应开始时,将装置C中铂丝加热到红热,撤去酒精灯,铂丝变暗。此时鼓入空气,铂丝又变红热。这是因为氨的催化氧化是_________反应。
(3)反应一段时间后,装置E中的气体颜色应为________________色。此时,装置E中的含氮化合物有NH3、NO、NO2、_________(填化学式)。
(4)反应一段时间后,装置F中的紫色石蕊试液变红,其原因是(写出化学方程式)__________________________。
(5)工业上合成氨的反应:N2(g)+3H2(g)
 2NH3(g);△H=-92.2kJ·mol-1。
2NH3(g);△H=-92.2kJ·mol-1。
下列做法能够提高工业氨转化率的是________________(选填字母)
a. 增大压强 b. 升高温度
c. 使用铁触媒 d. 将生成的NH3及时从混合气体中分离除去
24.如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。 H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。

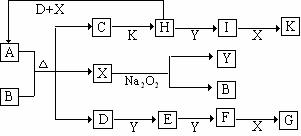
试回答下列问题;
(1)写出D(少量)、H、X反应生成A的化学方程式:________________________;
(2)写出D与K反应生成的正盐溶液中的离子浓度大小关系:________________;
(3)一定温度下,有可逆反应:aD(g)+bY(g)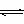 cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了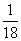 。则前2min内用E表示的平均反应速率__mol·L
。则前2min内用E表示的平均反应速率__mol·L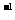 ·min
·min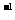 ,平衡时D的浓度为_________mol·L
,平衡时D的浓度为_________mol·L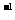 。
。
(4)已知:2H(g)+Y(g)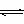 2I(g);△H=-196.6kJ·mol
2I(g);△H=-196.6kJ·mol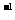 。当加入4mol H和2mol Y后,放出345 kJ的热时,H的转化率最接近于_______(填字母)。
。当加入4mol H和2mol Y后,放出345 kJ的热时,H的转化率最接近于_______(填字母)。
A、40% B、50% C、80% D、90%
23.近期“问题奶粉”引起了人们的极大关注。 其问题主要是奶粉中掺杂了三聚氰胺,三聚氰胺性状为纯白色晶体,无味,密度1.573克/厘米3 (16℃)。常压下熔点为354℃(分解),快速加热升华,升华温度为300℃;微溶于冷水,易溶于热水、醚、苯和四氯化碳,可溶于甲醇、乙酸、热乙二醇等。
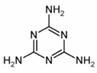
(1)三聚氰胺的结构简式如上图所示的环状物,则三聚氰胺的分子_________。三聚氰胺为三个氰胺分子加聚而成,已知氰胺分子中除H原子外,C、N 原子的最外层均达8个电子的结构,则氰胺的电子式为_______________, 三聚氰胺和相对分子质量相近的硝基苯比较 (无色或微黄色具苦杏仁味的油状液体。相对分子质量为123.11;熔点5.7℃。沸点210.9℃)。三聚氰胺的熔点特殊的高,其原因是______________________________。
(2)若称取含三聚氰胺的“问题奶粉”样品1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为 。
已知:滴定过程中涉及到的反应方程式:
(NH4)2 B4O7 + 2HCl + 5H2O = 2NH4Cl + 4H3BO3
22、在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)  p C(g)+q D(g)。
p C(g)+q D(g)。
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质_______mol 。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如下图所示。则T1(填“>”、“<”或“=”)________T2,该反应的正反应的△H(填“>”、“<”或“=”)_________0。
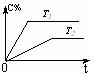
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如下图所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
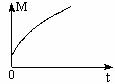
①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”) 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
21、A、B、C、D都是短周期元素,原子半径:D>C>A>B。已经A、B同周期,C、D 同周期, A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子的最外层电子数是D原子最外层电子数的4倍。A原子的最外层电子数是次外层电子数的2倍。
试回答:
(1)写出A元素的最高价氧化物的结构式:___________________________________。
(2)C的固态氧化物属于___________________晶体。
(3)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式 :____
_______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com