
14.一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
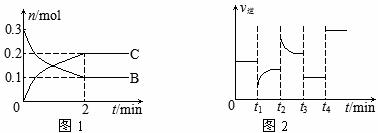
下列有关说法正确的是
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
13.常温下0.2mol/L HCN和0.1mol/L NaOH等体积混合后溶液pH>7,混合溶液中有关粒子物质的量浓度关系正确的是
A.c(HCN)+c(CN-)=c(Na+)
B.c(HCN)+2c(H+)=2c(OH-)+c(CN-)
C.c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D.c(HCN)>c(CN-)>c(Na+)>c(H+)>c(OH-)
12.酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。
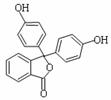
下列对该有效成分的说法正确的是
A.所有原子可能共平面
B.核磁共振氢谱中有7个峰
C.能发生加聚反应生成高分子化合物
D.1 mol该物质最多能与含3 molNaOH的烧碱溶液反应
11.下列反应的离子方程式正确的是
A.硫化钠的水解反应:S2-+H3O+ HS-+H2O
HS-+H2O
B.用铜做阳极电解氯化铜溶液:Cu2++2Cl-  Cu+Cl2↑
Cu+Cl2↑
C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
D.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
10.根据下列短周期元素性质的数据判断,下列说法正确的是
  |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10 m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
A.元素①⑧形成的化合物具有两性
B.元素⑦位于第二周期Ⅴ族
C.元素④⑤形成的化合物是离子化合物
D.元素③的最高价氧化物对应水化物碱性最强
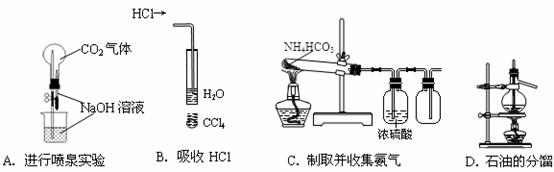
9.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
8.碱性锌锰电池工作时的总方程式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。关于碱性锌锰电池的说法正确的是
A.碱性锌锰电池是二次电池
B.正极反应为:2 MnO2+2H2O+2e-=2MnOOH+2OH-
C.连续工作后的碱性锌锰电池中电解液的pH将减小
D.工作中,每转移0.2 mol e-时,负极质量减轻6.5 g
7.某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是
A.NH4+、Ba2+、HCO3-、Cl- B.K+、Al3+、S2-、ClO-
C.Na+、Fe3+、Cl-、SO42- D.H+、Mg2+、SO42-、NO3-
6.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.0.1mol/L的NaOH溶液中钠离子数为0.1 NA
B.1.8 g重水(D2O)中,含有的质子数为0.1NA
C.5.6 g铁投入浓硫酸中,生成的气体分子数为0.1 NA
D.标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1 NA
5.下列各组物质中,不能满足“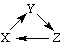 ”转化关系的一组是
”转化关系的一组是
|
|
X |
Y |
Z |
|
A |
Si |
SiO2 |
Na2SiO3 |
|
B |
CH2=CH2 |
CH3CH2Br |
CH3CH2OH |
|
C |
Al2O3 |
NaAlO2 |
Al(OH)3 |
|
D |
Cu |
CuO |
CuSO4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com