
6.下列各项内容中,排列顺序正确的是 ( )
① 固体的热稳定性:Na2CO3>CaCO3>NaHCO3
② 相同物质的量浓度的下列溶液中NH4+ 的浓度:(NH4)2SO4>(NH4)2CO3>NH4Cl
③ 微粒半径:K+>S2->F
④ 给出质子的能力:CH3COOH>C2H5OH>H2O
⑤ 氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
5.在指定环境中,下列各组离子一定可以大量共存的是 ( )
A.使pH试纸呈红色的溶液:Fe2+、NO3-、SO42-、Na+
B.使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、AlO2-
C.在加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3-
D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Mg2+、C1-、K+
4.下列实验操作或对实验事实的叙述正确的是 ( )
A.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
B.常温时,用pH试纸测得0.1 mol·L-1碳酸钠溶液的pH=7
C.如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
3.设NA为阿伏加德罗常数,下列叙述中错误的是 ( )
A.在标准状况下,22.4L空气中约有NA个气体分子
B.在含4molSi-O键的石英晶体中,氧原子的数目为2NA
C.28g乙烯和28g丙烯中均含有6NA对共用电子对
D.含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2︰3
2.下列文字表述与反应方程式对应且正确的是 ( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
B.等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+ Ba2++OH- = BaCO3↓ + H2O
C.NaHSO3溶液显酸性的原因是:HSO3- = SO32- + H+
D.硫化钠水溶液呈碱性的原因是:S2- + 2H2O  H2S + 2OH-
H2S + 2OH-
1.据《自然》杂志报道,在300-400℃的高温下,将砂糖(主要成分为蔗糖)等碳水化合物用加热的方法使其形成焦糖与碳之间的“半成品碳”状态,再放进硫酸溶液中高温加热,生成了一种叫“焦糖烯”的物质,其分子式为C36H50O25。下列有关说法正确的是 ( )
A.“半成品碳”在硫酸溶液中加热可能发生的是消去反应
B.“半成品碳”是碳元素的一种新单质
C.蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成
D.焦糖烯是一种新型的烯烃
29.(12分)维生素C(分子式为C6H8O6)可预防感染、坏血病等。其工业合成路线如下图所示:
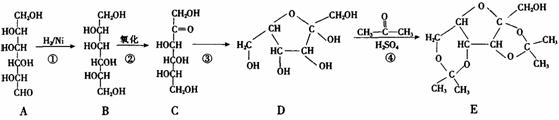
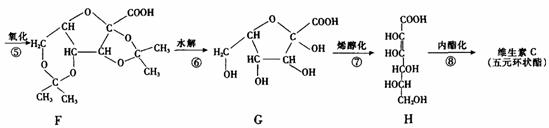
I.(1)上述①-③反应中,属于加成反应的有 (填数字序号)。
(2)A-G七种物质中与C互为同分异构体的有 (填字母序号)。
(3)比较D和G的结构可知,G可看成由D通过氧化得到。工业生产中在第⑤步氧化的前后设计④和⑥两步的目的是 。
(4)维生素C的结构简式是 。
Ⅱ.已知,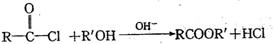 ,假设酸性条件下,上述步骤⑥的水解比酯的水解容易的多,
,假设酸性条件下,上述步骤⑥的水解比酯的水解容易的多,
利用本题中的信息,设计合理方案由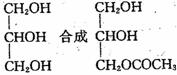
(用反应流程图表示,并注明反应条件)。 。
例:由乙醇合成聚乙烯的反应流程图可表示为
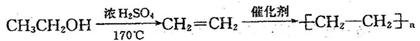
28.(12分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
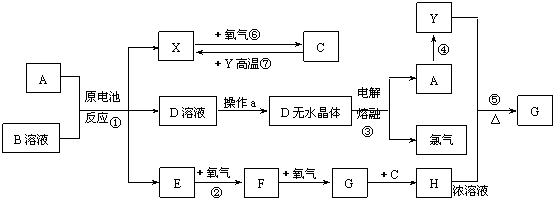

请填写下列空白:
(1)B的电子式___________,B中含有的化学键有_______________________________。
(2)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。
(3)从D溶液制备D的无水晶体的 “操作a”为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
27.(18分)A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,C元素原子最外层电子数是D元素原子最外层电子数的一半,B元素原子的最外层电子数比D的少两个。E也是短周期元素,与D同主族。
(1)D 和E分别与A形成的化合物中沸点较高的是(填化学式) 其原因是 。
(2)一定条件下由D和E形成的1mol化合物与E单质反应生成l mol气态产物,放出98.3 kJ的热量,则该反应的热化学方程式是: ;
(3)五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M是 (写化学式,写一个即可,下同),能抑制水电离的物质N是 。25℃时,pH=a的M溶液中水电离出的H+浓度与pH=a的N溶液中水电离出的H+浓度之比为 。
(4)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为
26.(16分)资料显示;“氨气可在纯氧中安静燃烧……。”某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
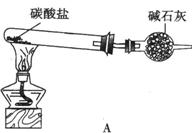
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
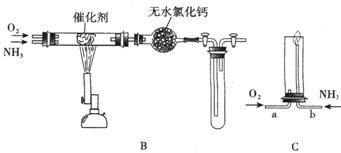
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该反应的化学方程式是 。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ,其理由是 。
②氨气燃烧的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com