
6.下列各组物质在适宜的条件下反应,其中氧化剂与还原剂物质的量之比为2:1的是( )
A.H2SO4(浓)+C B.Fe2O3+Al
C.Cl2+Mg D.NO2+H2O
26.(17分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
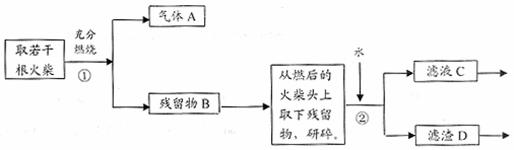
请回答以下问题:
(1)为验证气体A,按下图所示进行实验:若能观察到 的现象,即可证明火柴头上含有S元素。
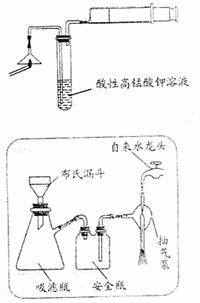
(2)步骤②的实验操作装置如上图所示,该操作的名称是 ,其工作原理是 。
(3)要证明火柴头中含有Cl元素的后续实验步骤是 。
(4)有学生提出检验火柴头上KClO3另一套实验方案:
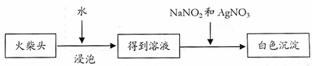
|
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。
|
实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
|
① |
30 |
5 |
0 |
85 |
2 |
3.8 |
|
② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
|
③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
|
④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
|
⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和 证明物质D的用量越大,反应速率越快。
(6)写出步骤①中发生反应的化学方程式 。
25.(7分)今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
|
阳离子 |
K+、NH4+、H+、Ba2+ |
|
阴离子 |
Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加入足量NaOH溶液加热后,收集到气体0.04mol
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。
请回答以下问题:
(1)100mL溶液中c(SO42-)= 。
(2)第三步实验中沉淀减少的原因是(用离子方程式表示) 。
(3)上述澄清溶液中除SO42-以外,一定能大量存在的离子是 。
24.(10分)已知H2B在水溶液中存在以下电离:
一级电离:H2B H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是 。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)·c(B2-),FeB在水中的沉淀溶解平衡曲线如下图所示。下列说法错误的是( )
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)·c(B2-),FeB在水中的沉淀溶解平衡曲线如下图所示。下列说法错误的是( )
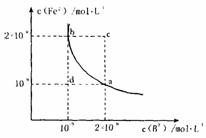
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
23.(10分)K2EO4(E代表某种元素)在工业上有重要的应用,以下是制备该物质的工艺流程图:
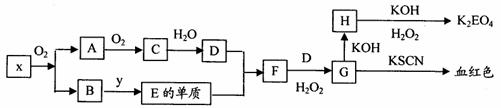
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是 ,H的化学式是 。
(2)写出F→G的离子反应方程式 。
(3)要实现B→E的转化,y的化学式可能是 。
(4)1molH转化为K2EO4时需H2O2的物质的量是 。
22.(8分)在体积为1L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),反应焓变为△H,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),反应焓变为△H,其化学平衡常数K和温度t的关系如下表:
|
T℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的△H 零(选填“>”或“<”)
(2)能判断该反应是否达到化学平衡状态的依据是 ( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
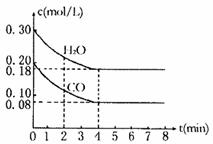
(3)若上述反应以CO和H2O蒸汽为起始反应物,在T℃时CO和H2O浓度变化如下图所示,则0-4min的平均反应速率v(CO2)= mol/(L·min),T= ℃。
21.(8分)A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。回答下列问题:
(1)A B (用元素符号表示)
(2)D的最高价氧化物对应水化物的化学式为 。
(3)C与E组成的常见化合物的电子式为 。
20.能促进水的电离,并使溶液中的c(H+)>c(OH-)的操作是 ( )
①将水加热煮沸 ②向水中投入一小块金属钠
③向水中通CO2 ④向水中加入明矾晶体
⑤向水中加入NaHCO3固体 ⑥向水中加NaHSO4固体
A.①②④⑤ B.①④⑤ C.③④⑤ D.④
第Ⅱ卷
19.在密闭容器中,反应X2(g)+Y2(g)  2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
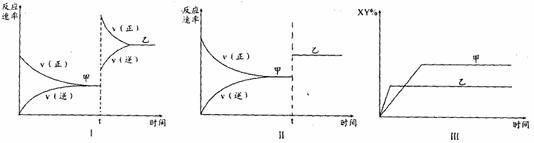
A.图I是加入适当催化剂的变化情况 B.图II是扩大容器体积的变化情况
C.图III是增大压强的变化情况 D.图III是升温温度的变化情况
18.取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 ( )
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com