
20.(10分)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应: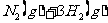

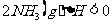 反应中NH3的物质的量浓度的变化情况如下图所示:请回答下列问题;
反应中NH3的物质的量浓度的变化情况如下图所示:请回答下列问题;
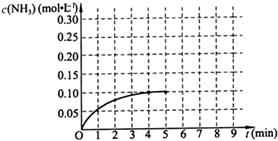
(1)根据上图,计算从反应开始到平衡时,平均反应速率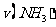 为
。
为
。
(2)该反应的化学平衡常数表达式K 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 。(填序号)。
a.0.20mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数
(填“增大”、“减少”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
19.(12分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
请回答下列问题;
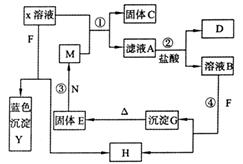
(1)E的化学式为
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是 。
(3)在反应①②③④中属于置换反应的是 (填序号)
(4)反应②的离子方程式为 。
(5)用石墨作电极电解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出点解时的阳极反应式 。
②电解后溶液的pH为 (假设电解前后溶液体积不变)。
18.(16分)I.化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置有些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
乙组: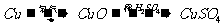 丙组:
丙组: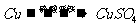
丁组: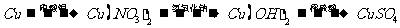
戊组: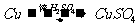
(1)甲组试验可用一个化学反应方程式表示为
;使反应变快的可能原因是
;从该反应器溶液(含有少量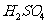 以抑制水解)中取得产品的试验操作步骤应为
、 、 ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的试验操作步骤应为
、 、 ,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,有科学性错误的是 组方案,有污染的是 组方案,无污染但能量消耗较高的是 组方案,因此选择 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解:
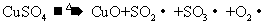 ,便决定设计试验测定反应生成的
,便决定设计试验测定反应生成的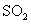 、
、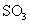 和
和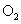 的物质的量,并经计算确定该条件下
的物质的量,并经计算确定该条件下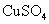 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
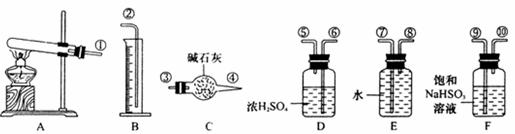
试验测得数据及有关结果如下;
①准确称取6.0g无水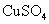 ;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3;按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
;②在试验结束时干燥管总质量增加2.4g;③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;试验结束时,装置F中的溶液只含NaHSO4和NaHSO3;按装置从左到右的方向,各仪器接口连结顺序为:①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(1)装置F的作用是 。
(2)装置D的作用是 。
(3)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。
② ,
③ 。
(4)通过计算,推断出该条件下反应的化学方程式
17.(2分)下列试验操作或对试验事实的描述正确的是 (填序号)
①用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸
②向NaOH沸腾的溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③用饱和NaHCO3溶液除去CO2中混合的少量HCl
④用加热的方法提取NH4Cl固体中混有的少量碘
⑤仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末
⑥测溶液的pH:用玻璃棒蘸取溶液滴在湿润pH的试纸上,与标准比色卡对照
16.三聚氰胺的结构如下图。“三聚氰胺”,有个貌似美妙的别名“蛋白精”,某些广告中曾公然标榜“能提高产品蛋白含量”。三聚氰胺性状为纯白色单斜棱晶体,无味,密度1.573g/cm3.(16℃)常压熔点354℃(分解);快速加热升华,升华温度300℃,溶于热水,微溶于冷水。关于三聚氰胺,下列说法不正确的是
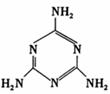
A.是蛋白质
B.是有机物,有弱碱性
C.将购回的奶粉溶于热水后冷却,过滤,可以粗略检测其中是否含有三聚氰胺
D.可以与盐酸反应
第II卷(非选择题 共58分)
必做题(17~21题)
15.一定温度下的难溶电解质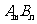 在水溶液中达到沉淀溶解平衡时,其平衡常数
在水溶液中达到沉淀溶解平衡时,其平衡常数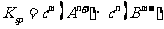 ,称为难溶电解质的离子积,在25℃时,
,称为难溶电解质的离子积,在25℃时,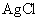 的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
|
物质 |
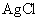 |
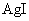 |
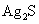 |
|
颜色 |
白 |
黄 |
黑 |
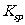 (25℃) (25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A.浓度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和溶液AgCl、AgI、Ag2S中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
14.经测定某种溶液中只含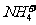 、
、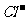 、
、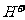 、
、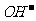 四种离子,下列说法不正确的是
四种离子,下列说法不正确的是
A.四种离子之间不可能满足: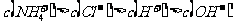
B.若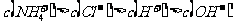 ,则溶质一定是
,则溶质一定是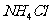 和
和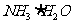
C.若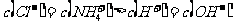 ,则溶液中溶质只有
,则溶液中溶质只有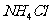
D.若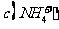
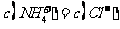 ,则溶液一定呈中性
,则溶液一定呈中性
13.下列表述正确的是
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式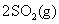 + O2(g)===2SO3(g)
+ O2(g)===2SO3(g)
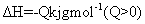 ,
,
则将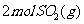 和1molO2(g)置于一密闭容器中充分反应后放出Q kJ 的热量
和1molO2(g)置于一密闭容器中充分反应后放出Q kJ 的热量
C.相同条件下:C(s)+1/2O2(g)==CO(g)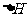 1
1
C(s)+O2(g)===CO2(g)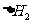 则
则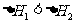
D.1molNaOH分别和1molCH3COOH、1molHNO3反应,后者必前者放出的热量多
12.下列离子方程式书写正确的是
A.漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2-+H2O===CaSO3â+2HClO
B.往氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O===[Al(OH)4]-+4NH4+
C.NaHS水解:HS-+H2O===S2-+H3O+
D.过量的NH4HSO4溶液与Ba(OH)2溶液反应:2H++SO2-4+Ba2++2OH-==BaSO4â+2H2
11.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A.X肯定是金属元素 B.Y、Z两元素可形成共价化和物
C.X的原子序数肯定小于Y和Z D.稳定性:Y的氢化物>Z的氢化物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com