
26.(14分)U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。
请回答下列问题:
(1)Z元素在周期表中的位置 。W、X、Y、Z四种元素的原子半径由小到大的顺序是 (用元素符号表示)。
(2)U与X形成的18电子化合物的电子式是 。
(3)ZX2与NaOH溶液反应的化学方程式是 。
(4)你认为U、W、X元素形成的化合物之间 (填“能”或“不能”)发生如下反应:WX + WU3→UWX2 + U2X,得出此结论的理由是
。
(5)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是 ,
将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共a L(标准状况),则Y单质的质量是 g(用含a的代数式表示)。
25.(16分)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍。
(1)A的分子式是 。
已知:各有机物间存在如下转化关系
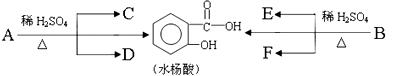
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(2)E中所含官能团的名称是 。完全燃烧时,1 mol D与1 mol 下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)B的结构简式是_______________________。水杨酸与小苏打反应的化学方程式是________________________________。C与F反应的化学方程式是 ,反应类型是____________。
(4)同时符合下列要求的同分异构体有_____种。
①与A互为同分异构体
②可以水解
③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1 mol上述(4)中的一种有机物X ,能与4 mol NaOH发生反应,写出此反应的化学方程式 。
12.一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:
m A(s)+ n B(g)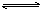 p C(g)+ q D(g) 达到平衡后,测得B的浓度为0.5
mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2 mol/L。当其它条件不变时,C在反应混合物中的体积分数(ф)与温度(T)时间(t)的关系如图所示。下列叙述正确的是 ( )
p C(g)+ q D(g) 达到平衡后,测得B的浓度为0.5
mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2 mol/L。当其它条件不变时,C在反应混合物中的体积分数(ф)与温度(T)时间(t)的关系如图所示。下列叙述正确的是 ( )
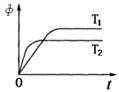
A.容积扩大到原来的两倍,平衡向逆反应方向移动
B.化学方程式中 n>p + q
C.达到平衡后,若升高温度,平衡向逆反应方向移动
D.达平衡后,增加A的量,有利于提高B的转化率
第Ⅱ卷(非选择题)
11.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
|
|
已知 |
类推 |
|
A |
将Fe加入到CuSO4溶液中 Fe+Cu2+ =Cu+Fe2+ |
将Na加入到CuSO4溶液中 2Na + Cu2+ = Cu + 2Na+ |
|
B |
氢氧燃料电池的负极反应(稀硫酸作电解质溶液)2H2 – 4e- == 4H+ |
氢氧燃料电池的负极反应(氢氧化钾溶液作电解质溶液)2H2 – 4e- + 4OH-== 4H2O |
|
C |
用惰性电极电解CuSO4溶液 2Cu2+ +2H2O  4H+
+O2↑+ 2Cu 4H+
+O2↑+ 2Cu |
用惰性电极电解CuCl2溶液 2Cu2+ + 2H2O  4H+
+O2↑+ 2Cu 4H+
+O2↑+ 2Cu |
|
D |
将少量CaCO3粉末投入足量盐酸中 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
将少量CaCO3粉末投入足量醋酸溶液中 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
10.下列选项中,微粒的物质的量浓度关系正确的是 ( )
A.向硝酸钾溶液中滴加稀盐酸得到pH=4的混合溶液:c(K+)= c(NO3-)
B.1.0 mol/L K2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
C.浓度均为0.1 mol/L的小苏打溶液和氢氧化钠溶液等体积混合:
c(Na+)+ c(H+)= c(CO32-)+ c(OH-) + c(HCO3-)
D.向氯化铵溶液中加入一定量氨水得到碱性混合溶液:
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
9.下列过程都与热量变化有关,其中表述不正确的是 ( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为
CO(g)+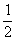 O2(g) === CO2 (g);△H=-283.0 kJ/mol
O2(g) === CO2 (g);△H=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
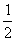 H2SO4(l)+ KOH(l)=
H2SO4(l)+ KOH(l)=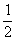 K2SO4(l)+H2O(l);△H=-57.3 kJ/mol
K2SO4(l)+H2O(l);△H=-57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
8.已知NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈蓝色。据此判断下列说法正确的是 ( )
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
7.下列除杂质的方法正确的是 ( )
A.用过量的碱液除去CO2中混有的少量HCl气体
B.用渗析(透析)的方法除去肾病患者血液中的毒素物质
C.用铁粉除去FeCl3溶液中少量的CuCl2
D.用过量的氨水除去Al3+溶液中的少量Fe3+
6.下列说法正确的是 ( )
A.合成氨生产过程中高温、高压的反应条件,均可加快正反应速率,提高NH3的产率
B.硫酸工业中,为了提高SO3的吸收效率,在吸收塔内用稀H2SO4作吸收剂
C.测定中和反应的反应热,使用环形铜棒搅动溶液
D.为测定硫酸铜晶体里的结晶水含量,至少应进行四次称量
5.某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物 ②煤和石油都是可再生能源 ③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 ④不锈钢和目前流通的硬币都是合金 ⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 ⑥豆浆和雾都是胶体。上述说法正确的是 ( )
A.①②④ B.①⑤⑥ C.①③④⑥ D.②③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com