
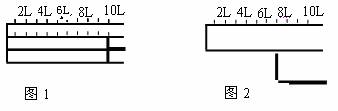
21.(10分)I.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中。
发生反应:2A(g)+B(g) 2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为___________;
2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为___________;
该条件下反应的平衡常数为_______________________________。
Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的化学方程式__________________________________________.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液做电解 质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式________________
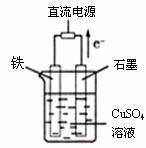
(3)有如下面化学实验装置图,石墨棒上的电极反应式为_______________;如果起始时盛有1000ml pH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),可向溶液中加入________(填物质名称),其质量为_______________.
20.(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题:
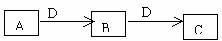
(1)若B、C 为氧化物,B转化为C时,质量增加25%,则B转化为C的化学方程式是
_____________.
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是____________;将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是__________________.
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是__________________;符合条件的D物质可能是_________(填序号)
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
19.(6分)化合反应是中学化学中最基本的反应类型之一。
已知:单质(1)+单质(2)=化合物,请写出满足以下要求的三个化合反应的方程式:
①所涉及的元素都是短周期元素;②6种单质分别属于6个不同的主族。
_______________________;_______________________;_____________________.
18.某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程
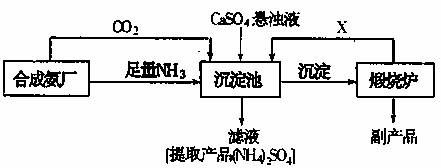
请回答以下问题:
(1)沉淀池中发生的主要反应是(用化学方程式表示)
______________________________________________________
(2)从滤液中获取((NH4)2SO4晶体,必须的操作步骤是__________(填写序号)
A.加热蒸干 B.蒸发浓缩 C.冷却结晶 D.过滤 E.萃取 F.分液
(3)该生产过程中可以循环使用的X是__________________.
(4)在生产中,要检查输送氨气的管道是否漏气,可选用____________(填写序号)
A.浓盐酸 B.湿润的蓝色石蕊试纸
C.湿润的淀粉碘化钾试纸 D.稀硫酸
E.湿润的红色石蕊试纸
16.下列表格中的各种情况,可以用下侧的图象曲线表示的是 ( )
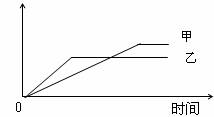
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
相同质量氨,在同一容器中 2NH3  N2+3H2 N2+3H2 |
氨气的转化率 |
500℃ |
400℃ |
|
B |
等质量钾、钠分别与足量水反应 |
H2质量 |
钠 |
钾 |
|
C |
在体积可变的恒压容器中,体积比1:3的 N2和H2,,N2+3H2  2NH3 2NH3 |
氨气的浓度 |
活性高的 催化剂 |
活性一般的 催化剂 |
|
D |
2mol SO2 与1molO2,在相同温度下 2SO2 +O2  2SO3 2SO3 |
SO3物质的量 |
10个 大气压 |
2个大气压 |
第Ⅱ卷(非选择题,共60分)
必做题(50分)
|
①用pH试纸测定Na2CO3溶液的 pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2 ·8H2O 晶体的NH4Cl 晶体反应过程中的能量变化
⑤实验室用新制的FeSO4 溶液和预处理过的NaOH 溶液制备Fe(OH)2白色沉淀
(2)用“大于”、“小于”、或“等于”填空:
①读取量筒中液体体积时,视线偏高,读取的体积数__________实际体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量____10.4g。
③配制500mL0.1mol·L-1NaOH 溶液,定容时俯视刻度线,所得溶液的物质的量浓度_____________0.1mol·L-1
④用中和滴定测某NaOH 溶液的浓度,量取待测液时末用该溶液润洗滴定管,测得的溶液浓度______________实际浓度
15.下列各组离子在指定溶液中,一定能大量共存的是 ( )
A.无色溶液中:[Ag(NH3)4]+、K+ 、H+ 、NO3―
B.能与铝片反应产生氢气的溶液中:Al3+ 、Cl― 、Fe2-、NO3―
C.常温下,pH=12的溶液中:SO32― 、Cl― 、K+ 、SiO32-
D.含有较多Fe3+ 的溶液中:Na+ 、SO42― 、SCN-、I―
14.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得工业盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应式这Cl2+2e-→2Cl―
13.下列溶液中,微粒的物质的量浓度关系正确的是 ( )
A.等体积等物质的量浓度NaF 溶液与HF混合:2c(Na+)=c(F―)+c(HF)
B.0.1mol·L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+) =c(HA―)+c(OH―)+c(A2-)
D.等物质的量浓度的(NH4)2SO4 和(NH4)2CO3溶液中的c(NH4+):前者<后者
12.下列对实验现象的表述正确的是 ( )
A.将装有等量的NO2 与N2O4 混合气体的两个容积相同的玻璃球分别浸入热水和冷水中,浸入热水中的玻璃球里气体颜色较浅
B.红热的铜丝可以在氯气中燃烧,生成黑色的固体
C.将稀盐酸滴到二氧化锰固体上立即产生黄绿色气体
D.将白色的硫化锌固体浸入硫酸铜溶液中,会发现固体逐渐变为黑色
11.在浓盐酸中H3AsO3与SnCl2反应的离子方程
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62++6M。关于该反应的说法中正确的组合是:①氧化剂是H3AsO3;②还原性:Cl- >As;③每生成0.1 mol As,反应中转移的电子的物质的量为0.3 mol。④M为OH- ( )
A.①③ B.①②④ C.②③④ D.只有①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com