
4.下图为电解饱和食盐水的简易装置,下列有关说法正确的是
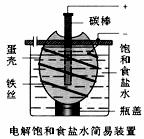
A.电解一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
3.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是
A.暖冰中水分子是直线型分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
D.暖冰是一种原子晶体
2.下列表示物质的化学用语正确的是
A.NH4H的电子式: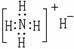 B.硝基苯的结构简式:
B.硝基苯的结构简式: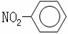
C.葡萄糖的实验式:CH2O D.甲烷分子的比例模型: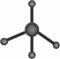
1.“神舟七号”发射成功,标志我国已具有深太空探测能力。据科学家预测,月球的土壤中吸附着数百万吨的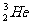 ,每百吨
,每百吨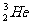 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以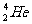 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是

A.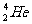 原子核内含有4个质子 B.
原子核内含有4个质子 B.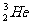 和
和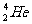 互为同位素
互为同位素
C. 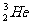 原子核内含有3个中子 D.
原子核内含有3个中子 D.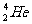 比
比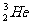 多1个电子
多1个电子
33.(8分)[化学--有机化学基础]
烃A 2.9g完全燃烧生成8.8g 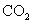 和4.5g
和4.5g 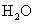 ,它的一氯取代产物B和C分别与强碱的醇溶液共热,都只能得到有机化合物D。请根据下图所示各有机物之间的转化填空:
,它的一氯取代产物B和C分别与强碱的醇溶液共热,都只能得到有机化合物D。请根据下图所示各有机物之间的转化填空:

(1)A的分子式为______________;
(2)写出结构简式:C___________________,E________________;
(3)B→D、G→H发生反应的反应类型依次是_____________、_____________;
(4)写出F→G的化学方程式______________________________。
32.(8分)[化学--物质结构与性质]
A、B、C、D四种元素处于同一周期,在同族元素,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
(1)C原子的价电子排布式为____________________;
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)______;
(3)B的单质分子中存在______个π键;
(4)D和B形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于_______晶体,其硬度比金刚石_____________(填“大”或“小”)
(5)A的气态氢化物的沸点在同族中最高的原因是_________________。
31.(8分)[化学--化学与技术]
请根据工业制硫酸的有关知识回答下列问题:
(1)黄铁矿在沸腾炉中反应的化学方程式为___________________________;
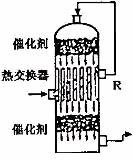
(2)在硫酸工业生产中,为了有利于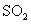 的转化,且能充分利用热能,采用了中间有热交换器的接触室(见下图)。按此密闭体系中气体的流向,则在R处流出的气体中除
的转化,且能充分利用热能,采用了中间有热交换器的接触室(见下图)。按此密闭体系中气体的流向,则在R处流出的气体中除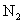 外的主要组成为________(填序号);
外的主要组成为________(填序号);
A.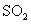 B.
B.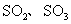
C.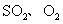 D.
D.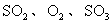
(3)接触法制硫酸过程中,反应2SO2(g)+ O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
则下列有关图像正确的是_______________(注: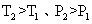 ,填序号);
,填序号);
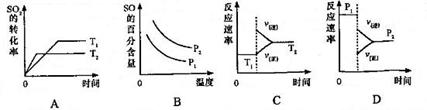
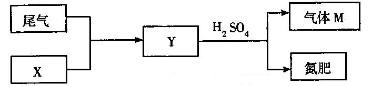
(4)下图是工业制硫酸尾气的综合利用,气体M回收后可进入接触室循环生产,请根据图示判断X是(填名称)_____,写出Y与硫酸反应生成M的化学方程式_____________。
30.(13分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:该反应的气体产物全部都是二氧化碳
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测量参加反应的碳元素与氧元素的质量比
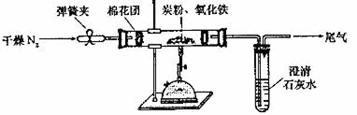
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(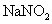 )饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式_____:
)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式_____:
(4)实验操作及实验现象;
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀。放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入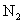 后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气,然后冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g。得出原假设不成立,理由是_________________________________________________。
(6)得出结论:根据数据处理结果判断,反应产生的气体是_____________________,
该实验中发生反应的化学方程式为_______________________________________。
(7)实验优化:根据实验得出的结论应对该实验装置进一步完善,请你从下图所示装置中选取必要装置,对实验加以改进___________________________________。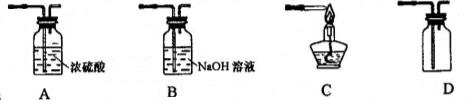
[选做部分]
共8个小题,考生必须从中选择2个物理题、1个化学体和一个生物题在答题卡规定的区域作答。
29.(16分)为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:
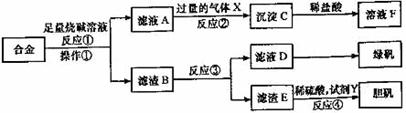
(1)操作①用到的玻璃仪器有_______________________________________;
(2)写出反应①的化学方程式_______________________________________;
反应②的离子方程式___________________________________________;
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)__________;
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是______________________________________;
(5)将滤渣B的均匀混合物平均分成四等份,每份13.2g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
|
实验编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属质量/g |
9.0 |
4.8 |
0 |
0 |
|
NO体积/L |
1.12 |
2.24 |
3.36 |
V |
试通过计算填空:
①写出实验①中发生反应的离子方程式_______________________;
②实验④中V=____________________________。
28.(13分)有关元素X、Y、Z、D、E的信息如下:
|
元素 |
有关信息 |
|
X |
元素主要化合价为-2,原子半径为0.074nm |
|
Y |
所在主族序数与所在周期序数之差为4 |
|
Z |
原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
|
D |
最高价氧化物对应的水化物,能按1:1电离出电子数相等的阴、阳离子 |
|
E |
其单质有多中同素异形体,一种为自然界中硬度最大 |
(1)画出Y的离子结构示意图_________________________;
(2)写出D的最高4氧化物的水化物电离出的阴离子的电子式_________;
(3)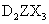 的溶液与Y的单质可能发生反应,其反应的离子方程式为__________;
的溶液与Y的单质可能发生反应,其反应的离子方程式为__________;
(4)用化学符号表示,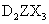 的水溶液中各离子的浓度关系________(列等式);
的水溶液中各离子的浓度关系________(列等式);
(5)已知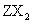 与
与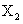 可发生反应2ZX2(g)+X2(g)
可发生反应2ZX2(g)+X2(g) 2ZX3(g)
△H<0;当反应达到平衡时不断改变条件(不改变
2ZX3(g)
△H<0;当反应达到平衡时不断改变条件(不改变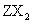 、
、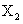 、
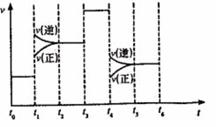
、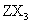 的量)反应速率随时间的变化如图:其中表示平衡混合物中
的量)反应速率随时间的变化如图:其中表示平衡混合物中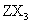 含量最高的一段时间是___________;如
含量最高的一段时间是___________;如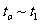 平衡常数为
平衡常数为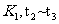 平衡常数为
平衡常数为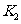 ,则
,则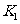 ________
________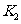 (填“大于”、“等于”或“小于”)。
(填“大于”、“等于”或“小于”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com