
15.在浓盐酸中,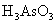 与
与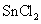 反应的离子方程式为:
反应的离子方程式为:
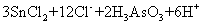
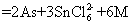 。关于该反应的说法中正确的组合是①氧化剂是
。关于该反应的说法中正确的组合是①氧化剂是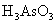 ②还原性:
②还原性: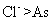 ③每生成7.5
③每生成7.5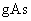 ,还原剂失去的电子为0.3
,还原剂失去的电子为0.3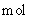 ④
④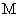 为
为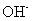 ⑤
⑤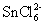 是氧化产物
是氧化产物
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
理科综合试题
第Ⅱ卷(必做120分+选做32分,共152.分)
第Ⅱ卷共:l6个题。其中23-30题为必做部分,考生可用黑色签字笔、钢笔或圆珠笔直接将答案写在答题纸上;31-38题为选做部分,考生必须从中选择2个物理、1个化学和1个生物题作答,多选、多做不计分。选做的题目,考生须用黑色签字笔、钢笔或圆珠笔写在答题纸上规定的位置;在试题卷上答题无效。
[必做部分]
14.下列叙述正确的是
A.浓度均为0.1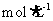 的
的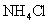 溶液与
溶液与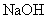 溶液混合,混合液中:
溶液混合,混合液中:
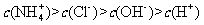
B.仅含有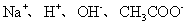 四中离子的某溶液中可能存在:
四中离子的某溶液中可能存在:
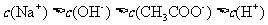
C.pH=12的氨水与pH=2的盐酸等体积混合后,混合液中:
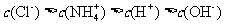
D.将pH=4的醋酸溶液加入稀释后,溶液中所有离子的浓度均降低
13.下列说法正确的是
A.在原电池工作时,溶液中的阳离子向负极移动
B.用惰性电极电解某溶液,若两极分别只有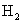 和
和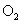 生成电解一段时间后,该溶液的浓度可能减小
生成电解一段时间后,该溶液的浓度可能减小
C.要使电解后的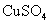 溶液复原,可向其中加入
溶液复原,可向其中加入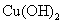 固体
固体
D.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀
12.用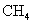 催化还原
催化还原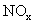 可以消除氮氧化物的污染。例如
可以消除氮氧化物的污染。例如
①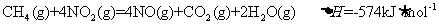
②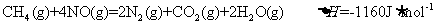
下列说法不正确的是
A.由反应①可推知: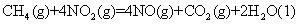
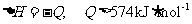
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48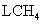 还原
还原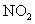 至
至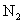 ,放出的热量为173.4kJ
,放出的热量为173.4kJ
D.若用标准状况下4.48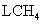 还原
还原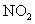 至
至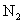 ,整个过程中转移的电子总数为1.6mol
,整个过程中转移的电子总数为1.6mol
11.下列说法中,不正确的是
A.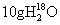 与
与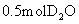 所含中子数相等
所含中子数相等
B.等物质的量的甲基(-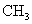 )与羟基(-
)与羟基(-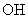 )所含质子数相等
)所含质子数相等
C.等物质的量的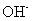 与
与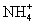 所含电子数与质子数均相等
所含电子数与质子数均相等
D.标准状况下,以任意比例混合的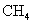 和
和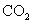 混合物22.4L,含有的分子数为
混合物22.4L,含有的分子数为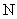
10.下列除去杂质的方法正确的是
①除去乙烷少量的乙烯:光照条件下通入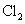 ,气液分离
,气液分离
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去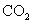 中少量的
中少量的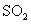 :气体通过盛饱和碳酸钠溶液的洗气瓶
:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
A.①② B.③④ C.②④ D.②③
9.生活是化学的源泉,下列有关生活中的化学叙述不正确的是
A.铁强化酱油可通过膳食补充人体所需的铁元素
B.不可用铝制餐具长时间存放酸性、碱性食物
C.一定浓度的双氧水可用于伤口的消毒
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
23.(10分)试验室一试剂瓶的标签严重破损,只能隐约看到如下部分:
取该试剂瓶中的试剂,通过燃烧试验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9g H2O.
(1)通过计算可知该有机物的分子式为
(2)进一步试验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体;②0.1mol该物质与足量金属钠反应可生成氢气2.24L(以折算成标准状况);③该物质在浓硫酸加热条件下生成含两个六元环的脂类;④该物质能发生消去反应。则该物质的结构简式为 。
(3)A经下列转化可以生成该物质,若取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。
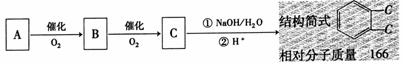
①写出A转化成B的化学方程式:
;其反应类型为
②写出C发生水解反应的化学化学方程式:
。
[化学-物质结构与性质]
22.(10分)
(1)I 短周期某主族元素M的电离能情况如下图A所示。则M元素位于周期表的第 族
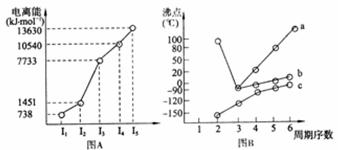
II 图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对ⅦA族元素氢化物的沸点地变化趋势画出了两条折线a和b,你认为正确的是 (填“a”或“b”)
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有
(填序号):
A.2个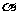 键 B.2个
键 B.2个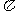 键 C.1个
键 C.1个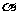 键、1个
键、1个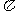 键
键
(3)金属钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,Ti元素基态原子的价电子排布式
[化学-有机化学基础]
21.(8分)已知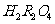 在水溶液中存在以上电离:
在水溶液中存在以上电离:
一级电离: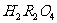

 二级电离:
二级电离: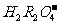

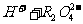
请回答一下问题:
(1)将0.1 mol·L-1的NaOH溶液与0.05 mol·L-1的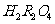 溶液等体积混合,冷却至室温测得溶液的pH
(填“等于7”、“大于7”或“小于7”)
溶液等体积混合,冷却至室温测得溶液的pH
(填“等于7”、“大于7”或“小于7”)
(2)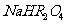 溶液 (填“呈酸性”、“呈碱性”或“无法确定”)。原因是
。
溶液 (填“呈酸性”、“呈碱性”或“无法确定”)。原因是
。
(3)某温度下,在0.1 mol·L-1的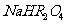 溶液中,以下关系一定不正确的是( )
溶液中,以下关系一定不正确的是( )
A.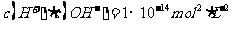
B.pH>1
C.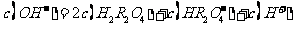
D.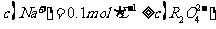
选做部分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com