
19.(12分)
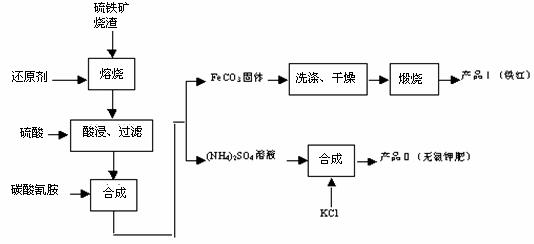
硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
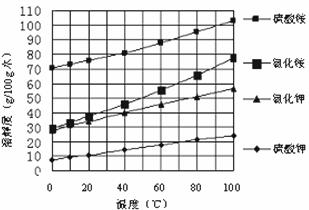
已知几种盐的溶解度随温度变化的曲线如下图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。
实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有_________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
。
18.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O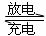 Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是 ( )
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是 ( )
A.放电时电池内部OH-向负极移动
B.放电时正极附近溶液的pH减小
C.充电时阳极反应为Cd(OH)2+2e-== Cd + 2OH-
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
17.利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 ( )
Ni(s)+ 4CO (g)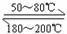 Ni(CO)4 (g)
Ni(CO)4 (g)
A.50-80℃时,适当增大压强,有利于Ni(CO)4的生成
B.该反应的平衡常数表达式是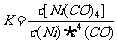
C.50-200℃范围内,该反应的平衡常数随温度的升高而减小
D.利用上述原理提纯粗镍需要消耗大量的CO气体
16.常温下二价锌在水溶液中的存在形式与pH的关系如图,纵坐标为Zn2+或Zn(OH)42-物质的量浓度的对数。下列说法正确的是 ( )
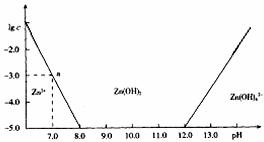
A.pH<12的溶液中不存在Zn(OH)42-
B.如果溶液中c(Zn2+)=0.1 mol·L-1,则c(H+)≥1×10-6 mol·L-1
C.控制pH在8-12可以分离出溶液中的锌离子
D.Zn(OH)2(s) Zn2+(aq)+ 2OH-(aq)的平衡常数为1×10-10
Zn2+(aq)+ 2OH-(aq)的平衡常数为1×10-10
15.下列表述正确的是 ( )
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
14.X、Y、Z和W代表原子序数依次增加的四种短周期元素,在周期表中,Z与Y相邻,Z与W也相邻,Y、Z和W三种元素的原子最外层电子数之和为17,X能分别与Y、Z形成电子总数相等的分子A、B。下列有关判断正确的是 ( )
A.Y与W的非金属性均比磷元素强
B.原子半径由大到小的顺序为:W>Z>Y
C.化合物B中焓变含有的化学键均为非极性共价键
D.X的单质是一种有广阔前景的新能源
13.常温下有体积相同的四种溶液:
①pH=3的CH3COOH溶液; ②pH=3的HCl溶液;
③pH=11的氨水; ④pH=11的NaOH溶液。
下列说法正确的是 ( )
A.②和③混合,所得混合溶液的pH大于7
B.③与④分别用等浓度的硫酸中和,消耗硫酸的体积:③=④
C.①与②分别与足量的镁粉反应,生成H2的量:①<②
D.若将四种溶液稀释100倍,溶液的pH大小顺序是:③>④>①>②
12.下列化学反应的离子方程式正确的是 ( )
A.向NaOH溶液中通入足量SO2: SO2 + 2OH- === SO32- + H2O
B.向KI与稀硫酸的混合溶液中通入氧气: 4H+ + 4I-+O2=== 2I2 +2H2O
C.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:
HCO3-+Ba2++OH-=== BaCO3↓+ H2O
D.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2+ + 2H2O2 + 4H+ === Fe3+ + 4H2O
11.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是 ( )
A.0.1 mol 过氧化钠与足量水反应生成的O2分子数为0.1nA
B.标准状况下,11.2L四氯化碳含有的分子数为0.5nA
C.1mol S在足量O2中燃烧,转移的电子数为6nA
D.常温常压下,16g的O2和O3混合气体含有的原子数为nA
10.反应A(g)+B(g) C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
( )
C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
( )
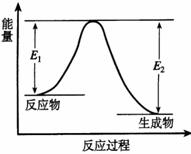
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H < 0,反应达到平衡时,升高温度,A的转化率增大
D.△H > 0,反应达到平衡时,升高温度,A的转化率减少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com