
2.广东正在建设海洋强省。下列说法不正确的是
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
1.我国稀土资源丰富。下列有关稀土元素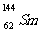 与
与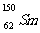 的说法正确的是
的说法正确的是
A.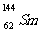 与
与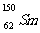 互为同位素
互为同位素
B.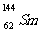 与
与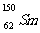 的质量数相同
的质量数相同
C.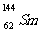 与
与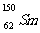 是同一种核素
是同一种核素
D.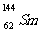 与
与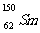 的核外电子数和中子数均为62
的核外电子数和中子数均为62
21.(12分)本包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出其态Zn原子的核外电子排布式 。
(2)根据等电子原理,写出CO分子的结构式 。
(3)甲醇催化氧化可得到甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;1 mol 甲醛分子中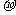 键的数目为 。
键的数目为 。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
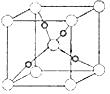
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
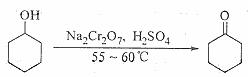
环己醇、环己酮和水的部分物理性质见下表:
|
物质 |
沸点(℃) |
密度(g·cm-3,20 ℃) |
溶解性 |
|
环己醇 |
161.1(97.8) |
0.9624 |
能溶于水 |
|
环己酮 |
155.6(95) |
0.9478 |
微溶于水 |
|
水 |
100.0 |
0.9982 |
|
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~156 ℃馏分,b.过滤; c.在收集到的馏分中加NaCl固体至饱和,静置,分液;d.加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
20.(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
 N2O4(g)达到平衡。
N2O4(g)达到平衡。
其他条件不变时,下列措施能提高NO2转化率的是 (填字母)
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l)======3N2(g)+4H2O(l)的ΔH= kJ·mol-1。
(3)17℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2为混合气体(17℃、1.01×105 Pa),理论上至少需消耗Cu多少克?
19.(14分)多沙唑嗪盐酸是一种用于治疗高血压的药物。多沙唑嗪的合成路线如下:
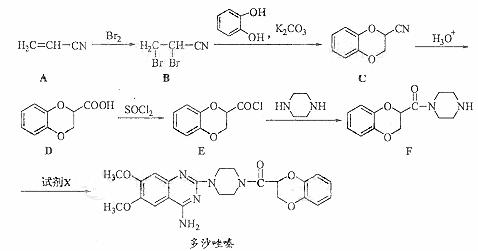
(1)写出D中两种含氧官能团的名称: 和 。
(2)写出满足下列条件的D的一种同分异构体的结构简式 。
①苯的衍生物,且苯环上的一取代产物只有两种;②与Na2CO3 溶液反应放出CO2气体;③水解后的产物才能与FeCl3溶液发生显色反应。
(3)E→F的反应中还可能生成一种有机副产物,该副产物的结构简式为 。
(4)由F制备多沙唑嗪的反应中要加入试剂X(C10H10N3O2Cl),X的
结构简式为 。
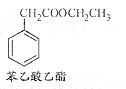
(5)苯乙酸乙酯是一种常见的合成香料。请设计合理的方案以苯甲醛和乙醇为原料合成苯乙酸乙酯(用合成路线流程图表示,并注明反应条件)。
提示:①R-Br+NaCN →R-CN+NaBr; ②合成过程中无机试剂任选;③合成路线流程图示例如下:
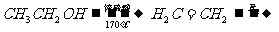
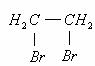
18.(10分)二氧化氧(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(2)用ClO2处理过的饮用水(pH为5.5-6.5)常含有一定量对人体不利的亚氯酸根离子的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2===Na2S4O6+2NaI
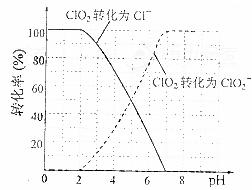
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0-8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1 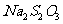 溶液滴定至终点,消耗
溶液滴定至终点,消耗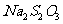 溶液
溶液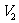 ml
ml
③根据上述分析数据,测得该饮用水样中CIO-2的浓度为 mol·L-1(用含字母的代数式表示。)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2- 还原成Cl- , 该反应的氧化产物是 (填化学式)。
17.(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+
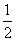 O2(g)===H2O(l)
ΔH=-285.84kJ·mol-1
O2(g)===H2O(l)
ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
16.(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
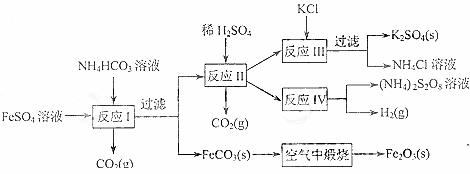
(1)反应I前需在FeSO4溶液中加入_____ _____(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
15.(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
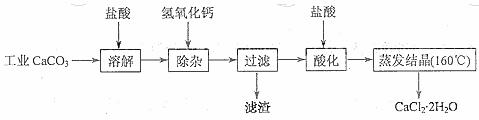
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是_____ _____。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_____ _____。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;C.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有_____ _____。
②计算上述样品中CaCl2·2H2O的质量分数为_____ _____。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有_____ _____;_____ _____。
14.I2在KI溶液中存在下列平衡: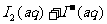

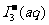 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应I2(aq)+I-(aq)===I3-(aq)的 H>0
H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有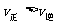
D.状态A与状态B相比,状态A的c(I2)大
非选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com