
13.以惰性电极电解饱和食盐水,当电路中通过0.2mol电子时,阴极上产生(标准状况)( )
A.3.36L O2 B.1.12L H2 C.2.24L Cl2 D.2.24L H2
第Ⅱ卷
12.常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后恰好完全反应(不考虑混合后溶液体积的变化),则下列说法不正确的是( )
A.反应后的溶液呈中性
B.醋酸和氢氧化钠溶液混合前溶质物质的量浓度相同
C.反应后溶液中:C(H+)·C(OH-)=10-14
D.反应后溶液中存在平衡:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
11.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液均能反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是( )
A.a一定为KOH B.b一定为KHSO4
C.c一定为AlCl3 D.e一定为MgCl2
10.下列实验操作中试剂滴加先后顺序正确的是( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.在制取干燥纯净的氯气时,先使氯气通入饱和食盐水,后通过浓硫酸
C.检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.配置银氨溶液:在洁净的试管中加入1ml 2%的稀氨水,然后加入过量AgNO3溶液
9.下列化学反应中,水既不是氧化剂又不是还原剂的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.2F2+2H2O=4HF+O2↑
C.2Na+2H2O=2NaOH+H2↑ D. NaH+H2O=NaOH+H2↑
8. 判断下列有关化学基本概念的依据正确的是
A.强弱电解质:溶液的导电能力大小 B.氧化还原反应:元素化合价是否变化
C.金属晶体:晶体是否能够导电 D.同系物: 是否具有相同的通式
7.某烷烃的一种同分异构体只能生成一种氯代物,则该烃的分子式不可能的是( )
A.C2H6 B.C4H10 C.C5H12 D.C8H18
29.(10分)现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+ 离子比B3+ 离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)B、C、D、E依次各是什么元素(填元素名称):
___ 、 、 、 。
(2)比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱(用相应的离子符号表示):
离子半径:_______________________;氧化性:_________________________。
(3)用电子式表示C元素最高价氧化物的形成过程:
。
(4) 写出E与冷水反应的离子方程式:_____________ __。
28.(16分) 已知:
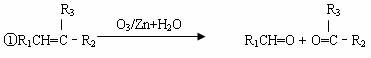
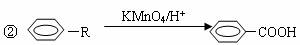
今有A、B、C、D、E、F、G、H、I、J、K几种有机物,其中A为烃,相对分子质量为84,它们之间的转化关系为:
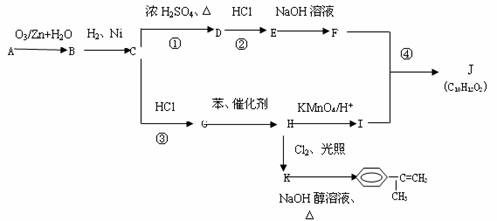
请回答下列问题:
(1)①②③步转化中涉及的反应类型是① ;② ;③ 。
(2)A的结构简式为 。
(3)反应④的化学方程 。
(4)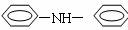 在一定条件下可以与
在一定条件下可以与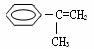 发生反应生成
发生反应生成
 ,该反应属于
反应。
,该反应属于
反应。
(5)有机物E和G之间的关系是 (填写序号)。
①同一物质 ②同分异构体 ③同系物 ④同素异形体
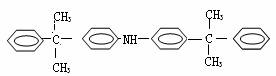
(6)写出同时符合下列两项要求的J (C10H12O2)的所有同分异构体的结构简式。
①化合物苯环上两个取代基处于对位,取代基分别为甲基和含有‑COO-结构的基团
②1mol化合物能与1mol NaOH溶液发生化学反应
、
、
27.(18分)某同学为探究浓硫酸的性质,设计了以下实验装置图。检查好装置的气密性后,向烧瓶中加入过量的铁粉、炭粉,再滴加浓硫酸。
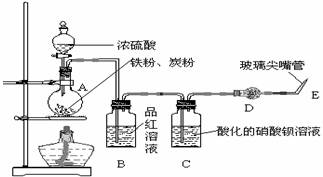
(1)未点燃酒精灯前,该同学观察到B中没有出现明显现象,这是因为
点燃酒精灯后,烧瓶内可能发生的化学反应为:
2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
随着反应的进行,还可能发生其它反应,试写出其中两个反应的离子方程式:
(2)当反应进行一段时间后,在C瓶中观察到有白色沉淀产生,该沉淀是 (填化学式),在点燃E处产生的气体之前要先进行验纯,请简述验纯操作及有关现象
(3)在烧瓶中的炭粉,可以使E处产生气体的速率加快,原因是:
(4)反应结束后,安装好过滤装置。先用少量热水通过过滤器,以提高它的温度,然后将烧瓶中的溶液趁热过滤。将滤液转入试管中,用橡皮塞塞住管口,静置、冷却。可以看到硫酸亚铁晶体在试管中结晶析出。将析出的晶体过滤、干燥、称重,得硫酸亚铁晶体2.69g。将全部晶体转入硬质玻璃管中,高温加热至质量恒定不变。在标况下,测得产生的气体为0.112L。
已知:硫酸亚铁晶体在受热时发生的反应为:
2FeSO4·xH2O Fe2O3+SO2↑+SO3↑+2xH2O 。请回答:
①提高过滤器的温度的目的是
②用橡皮塞塞住管口的目的是
③求该晶体中所含结晶水的个数x=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com