
28.(14分)已知2A2(g)+B2(g)  2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较a____________b(填>、=、<)
(2)若将反应温度升高到700℃,反应达到平衡c(A2)_______(增大、减小或不变)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量ckJ,C3浓度________(填>、=、<)w mol/L,a、b、c之间满足何种关系__________________(用代数式表示)
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出C3气体; b.选择高效的催化剂; c.增大B2的浓度
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,
500℃时充分反应达平衡后,放出热量dkJ,则d___b(填>、=、<),理由是________ _。
27.(16分)回答下列Ⅰ、Ⅱ两小题
Ⅰ.下列实验操作或对实验事实的描述正确的是 (填序号)
①仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末;
②实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
③配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏低;
④用瓷坩埚熔化各种钠的化合物;
⑤分液时,先从分液漏斗中倒出上层液体,后放出下层液体;
⑥测溶液大致的pH,用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同;
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。
Ⅱ.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
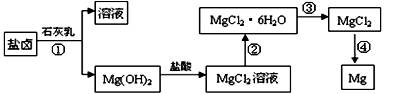
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、
(填操作方法)可除去Ca(OH)2
(3)下图是该兴趣小组设计进行过程③的实验装置图:其中装置A的作用是: 。
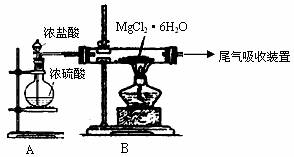
(4)写出过程④中发生反应的化学方程式 。
26.(12分)有A、B、C、D四种短周期元素,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,且A、B、C分别与D形成三种化合物分子所含的电子数相等,请回答:
(1)X、Y、Z、W都是由上述元素中的两种组成的化合物,若X分子的空间构型为三角锥型,则X的电子式为 ;已知Y被称为绿色氧化剂,Z与Y具有相同的电子数,两者在液态时常一起作为火箭推进器的燃料,且已知0.8gZ与Y作为火箭推进剂时,能放出20.44KJ的能量(产物均为气态),请写出该反应的热化学方程式:
。W是中学化学中常见的物质,其分子的空间构型为直线型,且所含有的原子数多于2个,其可能的化学式为 (只要写出2个)。
(2)甲是由上述元素中的三种组成的物质,甲属于无机盐类,其水溶液明显显酸性,是因为 (用离子方程式表示)
13.有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A的一种核素的原子核为质子,B原子的最外层电子数是次外层电子数的2倍。B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和。下列推论正确的是 ( )
( )
A.A、B两元素只能形成一种化合物
B.D、E两元素的最高价氧化物对应的水化物均为强碱
C.C的气态氢化物的稳定性一定小于F的气态氢化物
D.C、F两种元素可能形成原子晶体型的新型无机非金属材料
第Ⅱ卷(综合题)
12.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
11.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O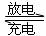 3Zn(OH)2 +
2Fe(OH)3 +
4KOH下列叙述不正确的是
3Zn(OH)2 +
2Fe(OH)3 +
4KOH下列叙述不正确的是
( )A.放电时负极反应为:Zn - 2e- + 2OH- == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- == FeO42- + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
10.下列各组离子中,一定能大量共存的是( )
A.加入铝粉有氢气产生的溶液中:H+、K+、NO3-、C1-
B.pH = 0的无色溶液中:Na+、K+、MnO4-、NO3-
C.在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+
D.某无色中性溶液中:Cl-、SO42-、Na+、Mg2+
9.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2
+ 3C  2 AlN + 3CO 下列叙述正确的是( )
2 AlN + 3CO 下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
8.用NA表示阿伏加德罗常数值,下列说法中正确的是( )
A.常温常压下,32gO2和48gO3所含氧原子数都是2NA
B.1molMg在空气中完全燃烧,生成MgO和Mg3N2,转移电子数是2NA
C.1molCH3OH在燃料电池负极发生完全反应时转移的电子总数是4NA
D.100mL0.1mol·L-1CH3COONa溶液含CH3COO-的数目是0.01NA
7.下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是( )
A.氯化镁、氢氧化钠 B.硫酸钠、氢氧化钡
C.氯化铝、氨水 D.溴化亚铁、氯水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com