
8. 下列反应对应的离子方程式中正确的是
A.FeCl3溶液中加入铁粉:Fe+Fe3+ 2Fe2+
B.NH4HSO4溶液中加入少量NaOH:NH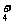 +OH-
+OH- NH3·H2O
C.明矾溶液中加入过量氨水:A13++3NH3·H2O=Al(OH)3↓+3NH4+
D.氯气通入Na2SO3溶液中:Cl2+SO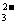 +H2O
+H2O SO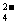 +2HCl
+2HCl
7.某酸式盐NaHA的水溶液呈碱性,下列叙述正确的是
A.NaHA的电离方程式:NaHA Na++H++A2-
B.HA-的水解方程式:HA-+H2O  H3O++A2-
H3O++A2-
C.该溶液中离子的物质的量浓度关系:
C(Na+)>C(HA-)>C(OH-)>C(H+)>C(A2-)
D.该溶液中离子的物质的量浓度关系:
C(Na+)+ C(H+)= C(OH-)+ C(A2-)+ C(OH-)
6.人类生活离不开化学知识,下列叙述不正确的是
A.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质
B.因患“禽流感”而被捕杀的家禽尸体常用生石灰处理
C.医疗上常用体积分数为75%的酒精进行皮肤消毒
D.食品加工、消毒、防腐常使用福尔马林
29.(16分)已知:C2H5OH+HO-NO2(硝酸)→C2H5O-NO2(硝酸乙酯)+H2O
RCH(OH)2→RCHO+H2O
现有只含C、H、O的化合物A~E,其中A为饱和多元醇,其他有关信息已注明在下图的方框内。
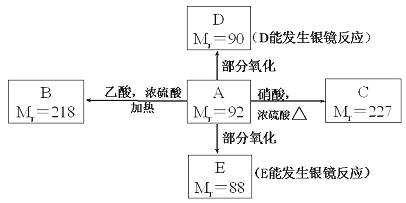
回答下列问题:
(1)A的分子式为 。(2分)
(2)写出下列物质的结构简式:
B (2分);D (2分)
(3)写出下列反应的化学方程式和反应类型(括号内):
A→C: (3分),(酯化反应或取代反应)(1分)
A→E: (3分),(氧化反应)(1分)
(4)工业上可通过油脂的皂化反应得到A,分离皂化反应产物的基本操作是 。(2分)
28.(16分)硫酸铜是一种应用极其广泛的化工原料,可用不同的方法制得硫酸铜。
I.将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
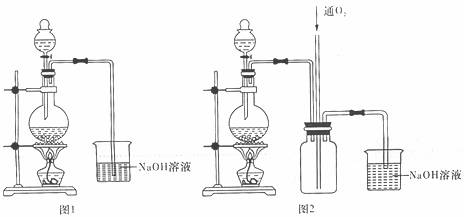
(1)图1分液漏斗内装的液体是_____________。
(2)图2是图1的改进装置,与图1相比,图2装置的明显优点是
。
II.为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:将铜粉在坩埚中反复灼烧,与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入铜粉与稀硫酸的混合物中,向反应液中加FeSO4或
Fe2(SO4)3,即发生反应。反应完全后加CuCO3调节pH到3-4,产生Fe(OH)3沉淀,过滤、蒸发、结晶得CuSO4·5H2O。滤渣可循环使用。
(3)写出加入FeSO4或Fe2(SO4)3后发生反应的相关的离子方程式:
。
第二组:过氧化氢为氧化剂法
将少量铜丝放到适量的稀硫酸中,温度控制在50℃。加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后。过滤、蒸发结晶等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 。
(4)其中用少量95%的酒精淋洗的目的是 ;若需要得到25.0 g硫酸铜晶体,至少需要30%(密度为1.1g/cm3 )的H2O2 mL。
(5)上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是
。
27.(14分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质溶液,构成原电池。有关物质之间的转化关系如图(其中有些反应的条件及部分生成物略去)
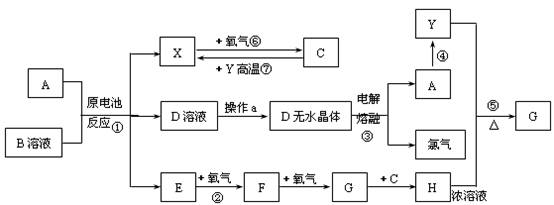
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为:
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为______________________________________________。
(5)原电池反应①中正极的电极反应式为 。
26.(14分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式是______________________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________________
(3)X的硝酸盐水溶液显______性,用离子方程式解释原因:
____________________________________________________________________
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
____________________________________________________________________
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 。(2分)
(6)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式 。
13.按下图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是 ( )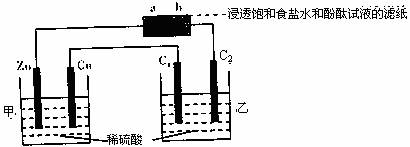
A.Zn电极质量减轻3.25g时,Cu电极上放出气体在标准状况下体积约为1.12L
B.a点附近显红色
C.C1、C2电极所产生气体的体积比为2:1
D.乙池溶液的pH逐渐减小
第Ⅱ卷(非选择题,共174分)
12.向1.00L 0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中离子浓度大小不正确的是 ( )
A.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
B.2c(HCO3-)+2c(CO32-)+2c(H2CO3)=c(Na+)
C.c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L
D.c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+)
11.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是 ( )
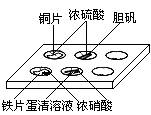
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变白
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色
A.①④ B.②③ C.①⑤ D.②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com