
6.日常生活中常用到化学知识,下列说法不正确的是
A.白色污染、绿色食品中的“白”、“绿”均指相关物质的颜色
B.用食醋可以除去热水壶中的水垢
C.聚氯乙烯塑料有毒,不可用于制食品包装袋
D.新制的Cu(OH)2可以检测糖尿病患者尿液中是否含有葡萄糖
33.(8分)[化学--有机化学基础]
已知当一个碳原子上连有两个羟基时,易发生下列转化:
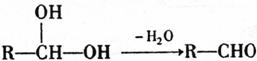
已知:A、B存在如下图转化关系,根据下图所示回答下列问题:
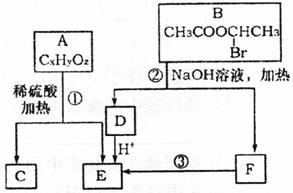
(1)物质B能发生的反应类型是_________填序号字母)。
a.取代反应 b.水解反应 c.消去反应
(2)已知相同情况下,等质量H2的体积是A蒸气体积的81倍。16.2gA在氧气中完全燃烧,生成44gCO2和9gH2O,则A的化学式为__________________。
(3)C是高分子光阻剂生产中的主要原料。C具有如下特点:能跟FeCl3溶液发生显色反应;能发生加聚反应;苯环上的一氯代物只有两种。写出反应①的化学方程式_________ ___________________________。
(4)化合物G是C的同分异构体,属于芳香族化合物,能发生银镜反应,G有多种结构,写出苯环上只有一个取代基的同分异构体的结构简式__________________。
32.(8分)[化学--物质结构与性质]
X、Y、Z、W四种元素位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51。Y原子的L层p轨道中有2个电子,Z与Y原子的价层电子数相同,W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y与X形成只含一个中心原子的共价化合物a,该分子中的中心原子轨道采用_________杂化成键,a分子的立体构型为_________。
(2)Y的最高价氧化物和Z最高价氧化物的晶体类型分别是_________晶体、_________晶体。
(3)X的氧化物与Y的氧化物中,分子极性较大的是(填分子式)_________。
(4)Y与Z比较,电负性较大的是_________(填元素符号)。
(5)W元素的名称是_________,W2+离子的核外电子排布式是_________。
31.(8分)[化学--化学与技术](本模块未命题)
30.(14分)某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:
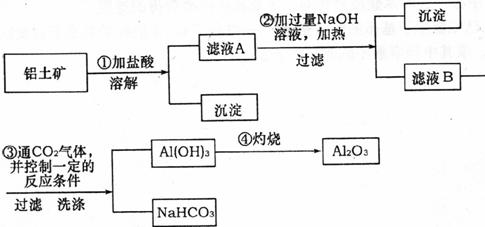
(1)在实验中需用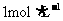 的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是__________________。在灼烧操作中用到下列仪器中的一种,其名称是_________。
的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是__________________。在灼烧操作中用到下列仪器中的一种,其名称是_________。
(2)与出步骤①中发生反应的离子方程式___________________________。
(3)操作③中洗涤如何操作_____________________________________________。
(4)甲同学在实验室中用下列装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
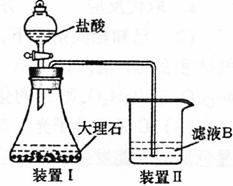
乙同学分析认为:甲同学通入CO2不足是导致实验失败的原因之一,你认为乙的分析是否合理?_________。若合理,请用离子方程式解释其原因__________________。(若你认为不合理,该空不作答)
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题。请帮助丙同学画出该装置图,并注明试剂名称。
[选做部分]
29.(11分)Ⅰ.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。
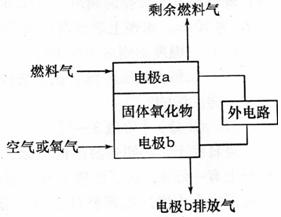
(1)电极b的电极反应式是___________________________。
(2)假设外电路是电解硫酸铜溶液的装置。若以C2H4为燃料气,工作一段时间后,燃料电池中消耗了标准状况下的2.24LC2H4,则外电路阴极区的产物及其物质的量分别是_____ ___________________________。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有的少量Na2S。
A.CuCl2 B.AgCl C.HCl
(1)最好的试剂是_________(填写序号字母)。写出加入该试剂时反应的离子方程式____________________________________。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:__________________。
28.(17分)氮的化合物在某些领域中扮演着重要的角色。
(1)氨和铵盐在粮食的增产中发挥着极其重要的作用,同时又是重要的工业原料。
①写出实验室制取氨气的化学方程式:___________________________。
②氨的催化氧化反应是工业制硝酸的基础,该反应在一定温度下(水为气体)为正反应放热的可逆反应,写出该反应的化学平衡常数表达式K=_________,升高温度,K的值_________(填“增大”、“减小”或“不变”)。
(2)硝酸是工业三大强酸之一。试从原料的利用率和环境保护两个角度分析,溶解等量的金属铜用浓硝酸好,还是稀硝酸好?写出反应的化学方程式并简要分析_________。
(3)氮的化合物在航天航空事业中起着不可替代的作用。
①神舟七号飞船的外壳是一种新型结构陶瓷材料,它的主要成分是氮化硅。工业上使用SiCl4、H2和N2在一定条件下反应生成氮化硅,写出该反应的化学方程式(不必配平)____________________________________。
②航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂,若以肼为燃料、二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知: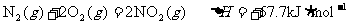
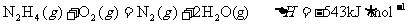
写出肼和二氧化氮反应的热化学方程式___________________________。
(4)三聚氰胺[C3N3(NH2)3]是一种重要的有机化工原料,因其含氮量高达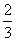 而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(以氮元素的质量分数N%表示)。某品牌奶粉中N%为1.9%,若在100g该奶粉中加入10g三聚氰胺,则N%提高为原来的_________倍(取整数)。
而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(以氮元素的质量分数N%表示)。某品牌奶粉中N%为1.9%,若在100g该奶粉中加入10g三聚氰胺,则N%提高为原来的_________倍(取整数)。
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.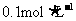 的
的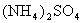 溶液中:
溶液中: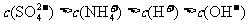
B.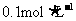 的NaHCO3溶液中:
的NaHCO3溶液中: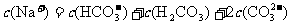
C.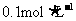 的NH4Cl溶液与
的NH4Cl溶液与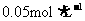 的NaOH溶液等体积混合:
的NaOH溶液等体积混合:
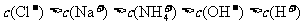
D.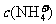 均为
均为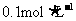 的NH4HSO4、NH4HCO3和NH4C1溶液:
的NH4HSO4、NH4HCO3和NH4C1溶液:
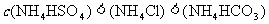
第Ⅱ卷
[必做部分]
14.在容积不变的密闭容器中有反应: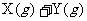

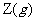 ,若
,若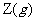 的物质的量浓度
的物质的量浓度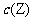 与温度
与温度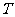 的关系如下图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是
的关系如下图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是
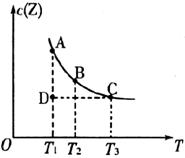
A.A点与B点相比,B点的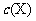 大
大
B.A点与C点的化学反应速率:前者<后者
C.在反应进行到D点时,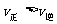
D.该反应的正反应是吸热反应
13.下图为元素周期表短周期的一部分。关于A-G七种元素的叙述正确的是
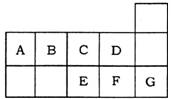
A.E、F、G形成的单质中都含有共价键
B.形成的简单阴离子半径:E>F>C>D
C.B、C、D三种元素的氢化物的稳定性依次减弱
D.A、B、E的氢化物都能跟HNO3发生化合反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com