
12.向一定量的Na2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中的离子数目也相应地发生变化(如图所示)。下列说法正确的是 ( )
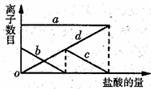
A.曲线a表示C1- B.曲线b表示CO32-
C.曲线c表示Na+ D.曲线d表示HCO3-
第Ⅱ卷
必考部分
第Ⅱ卷必考部分共9小题,共l57分。
11.下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生氧化反应
B.用石墨电极电解饱和NaC1溶液,若有1mol电子转移,则生成1molNaOH
C.用石墨电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
D.在相同环境下,镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
10.对于同温度、同体积、同密度的O2和O3两种气体,下列说法正确的是 ( )
A.两种气体的压强相等 B.两种气体的分子数相等
C.O2比O3的质量小 D.两种气体的氧原子数相等
9. 进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是 ( )
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝。说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明该溶液中一定含SO42-
D.将铜片放人浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
8.设NA为阿伏加德罗常数。在标准状况下,下列说法正确的是 ( )
A.5.6L四氯化碳占有的分子数为0.25NA
B.14g氮气含有的核外电子数为5NA
C.22.4L任意比的氢气和氧气的混合气体中含有的分子总数均为NA
D.铁跟稀硫酸溶液反应生成1mol氢气时,转移的电子数为NA
7.下列关于化学反应速率和化学反应限度的说法错误的是 ( )
A.决定反应速率的主要因素是反应物的性质
B.升高反应温度能加快正、逆反应速率
C.化学反应的限度是可以改变的
D.可逆反应达到化学平衡状态时,正、逆反应速率都为零
6.下列说法不正确的是 ( )
A.不能用丁达尔现象区别CuSO4溶液和Na2SO4溶液
B.天然油脂中含有高级脂肪酸甘油酯,许多水果中含有酯类化合物
C.由于Ksp(BaSO4)小于Ksp(BaCO3),因此不可能使生成的BaSO4沉淀再转化为BaCO3沉淀
D.植物及其废弃物可制成乙醇燃料,它是一种再生能源
29.(14分)绿色化学是化学实验追求的永恒目标。某研究性学习小组利用试管等仪器设计出一组“套管实验”装置,完善中学化学教材中一组实验,实现实验绿色化。]
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O
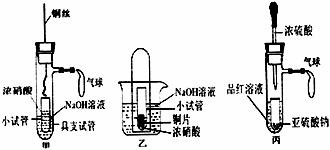
(1)甲装置中小试管内发生的离子方程式为
铜丝可以上下抽动,甲装置与乙装置相比,优点是:
。
(2)乙装置在实验过程中观察到大试管中液面上升,简述原因:
(3)实验时,可以观察到丙装置中的现象是
;若微热反应后的溶液放置片刻,又能观察到的现象是
。
(4)利用丙装置能完成多个实验。下列实验不能利用丙装置完成的是 。
A.证明氨气可使酚酞试液变红
B.氯的非金属性比碘强(常温下,氯酸钾与浓盐酸反应生成氯气)
C.乙炔能与溴的四氯化碳溶液反应
D.蔗糖与浓硫酸反应的产物有二氧化碳
28.(18分)已知:有机物A广泛存在于苹果、葡萄等水果中,经测定A中只含碳、氢、氮元素,其相对分子质量为134,含碳元素的质量分数为35.8%,A具有以下性质:
①A在一定条件下可发生分子内脱水,生成能使溴水反应褪色的物质;
②A与羧酸或醇在浓硫酸共热下均能生成具有香味的物质
③100mL 0.1mol/LA 溶液与足量NaHCO3溶液反应可产生标准状况下CO2448mL。
请回答下列问题:
(1)A所含官能团的化学式为 ,A不可以发生的反应有 (填序号)
①加成反应 ②酯化反应 ③氧化反应 ④消去反应
上述A的一种同分异构体A1没有支链,A1能发生如图转化关系,E为加聚产物,B为环状结构。回答下列问题:
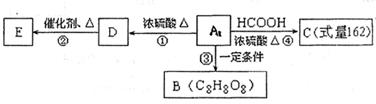
(2)A1的结构简式为 ,E的结构简式为
(3)写出④的化学方程式 。
(4)B的组成结构很有特点,符合条件的有机物B有 种结构,写出其中含有一个六元环的有机物B结构简式 。
(5)一定量的A物质与乙醇的混合物完全燃烧生成27g水和VLCO2(标准状况),则等物质的量该混合完全燃烧消耗氧气的物质的量为 。
27.(14分)
(1)在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入50 ml 0.5mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.
□FeSO4+□KNO3+□H2SO4→□K2SO4+□Fe2(SO4)3+□NxOy↑+□H2O
①反应中氧化剂为 .NxOy的化学式为
②在横线上填写氮氧化物的化学式,配平该方程式,用单线桥标出电子转移的方向和数目
□FeSO4+□KNO3+□H2SO4→□K2SO4+□Fe2(SO4)3+□ +□H2O
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
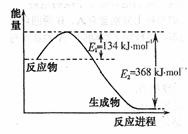
下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(3)Al单质晶体中原子的堆积方式如下图甲所示,其晶体最小重复单元特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
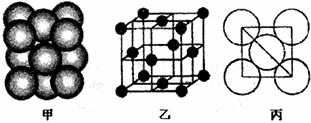
请回答:
晶体中距离Al原子最近的Al原子为 个,一个最小单元结构中Al原子的数目为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com