
28.(13分)明矾石是制取钾肥和氢氧化铝的重要材料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体制取步骤如下图所示(所加试剂均为足量):
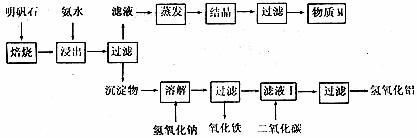
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL2.8mol·L-1的稀氨水需用16mol·L-1的浓氨水 mL。
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、NH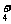 外,还有大量的
外,还有大量的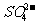 。检验
。检验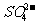 的方法是 。
的方法是 。
(3)写出物质M中所有物质的化学式 。
(4)写出沉淀物与氢氧化钠溶液反应的化学方程式 。
(5)取滤液I少放,加入过量盐酸;再用惰性电极电解所得溶液,两极均有气体产生,在阴极区还有沉淀生成,最后沉淀消失。写出阳极的电极反应式 。
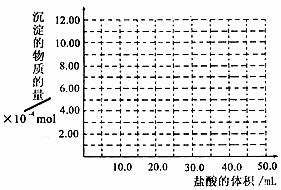
(6)取(5)电解以后的溶液10.0mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶液,向其中逐滴加入0.100mol·L-1盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
15.关于下列各装置图的叙述中,不正确的是 ( )
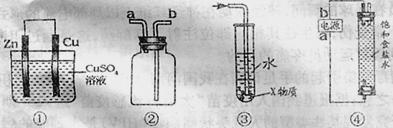
A.装置①中,电流从Cu经外电路向Zn
B.装置②可用于收集H2、CO2、Cl2、HCl、NH3等气体(必要时可添加尾气处理装置)
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸
D.装置④在制备NaClO消毒液时,a为电源负极
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
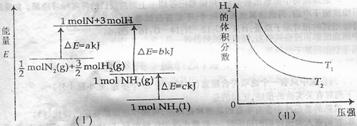
14.某温度时,N2与H2反应生成NH3,其能量变化如图(1)所示。温度分别为T1和T2时,H2的体积分数随压强的变化关系如图(II)所示。则下列结论不正确的是 ( )
A.该反应的热化学方程式为:
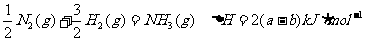
B.该反应的热化学方程式为:

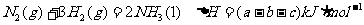
C.由上两图可知: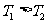 ,且正反应为放热反应
,且正反应为放热反应
D.其他条件不变,增大压强,正、逆反应速率均增大,但H2的转化率变小
13.下表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
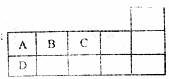
A.原子半径大小比较为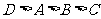
B.A与C形成的阴离子AC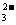 发生水解反应的离子方程式为:
发生水解反应的离子方程式为:



C.氢元素与A、B、C三种元素一起只能形成共价化合物
D.A、B、C、D的单质常温下均不导电
12.下图是常见四种有机物的比例模型示意图。下列说法正确的是 ( )
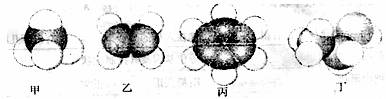
A.甲能使酸性高锰酸钾溶液褪色
B.乙可与溴水发生取代反应使溴水褪色
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D.丁在稀硫酸作用下可与乙酸发生取代反应
11.下列说法正确的是 ( )
A.在H2O2+Cl2==2HCl+O2反应中,每生成32g氧气,则转移4mol电子
B.100mL0.1mol/L醋酸溶液中的H+比10mLlmol/L醋酸溶液中的H+多
C.氯化锌溶液与硫化钠溶液反应生成白色沉淀,再加入少量硫酸铜溶液无明显现象
D.Al2(SO4)3溶液或NaHSO4溶液与NaHCO3溶液混合均放出CO2气体,该现象可用同一原理解释
10.下列说法中,正确的是 ( )
A.BaSO4是一种难溶于水的强电解质
B.冰醋酸、纯碱、小苏打分别属于酸、碱、盐
C.H2、D2、T2互为同位素,性质相似
D.牛油、甘油、植物油都属于酯类化合物
9.下列叙述不正确的是 ( )
A.采集某雨水样品,放置一段时间后,其pH值由4.8变为4.2,可能是溶解了较多的SO2
B.利用太阳能、风能和氢能替代化石能源有利于“蓝天工程”的建设
C.含磷合成洗涤剂易于被细菌分解,不会导致水体污染
D.为防止电池中的重金属离子污染土壤和水源,废电池要集中处理
33.(8分)[化学--有机化学基础]
CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
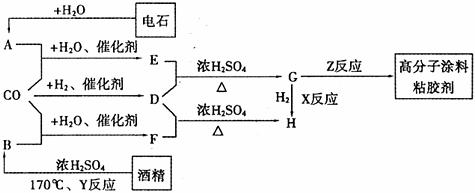
图中G(RCOOR,)的一种同分异构体是E的相邻同系物;H是含有4个碳原子、有芳香气味的化合物,且H的一种同分异构体是F的相邻同系物。已知D由CO和H2按物质的量之比为l:2完全反应而成,其氧化产物可发生银镜反应。试写出:
(1)G的结构简式 ,A的电子式: 。
(2)G的同分异构体中核磁共振氢谱只有一种峰的结构简式 。
(3)反应类型:X 、Y 。
(4)写出F与D反应生成H的化学方程式 。
32.(8分)[化学--物质结构与性质]
有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为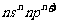 ;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
回答下列问题:
(1)D的前一元素第一电离能高于D的原因:________ _;
(2)由A、B、C形成的.ABC分子中,含有____ _个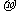 键,____
_个
键,____
_个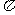 键;
键;
(3)由D、E、F、G形成的盐E:DF4、GDF4的共熔体在冷却时首先析出的物质是 _(写化学式),原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com