
1.
如果我们把三维空间里的周期系搬到一个想象中的“平面世界”去,那是一个二维世界。那里的周期系是根据三个量子数建立的,即n = 1,2,3……,m
= 0,±1,±2,±3……±(n-1), ms = 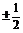 。其中m相当于三维世界中的l和ms两者的作用(例如用它也能表示s、p、d……)。另外,在三维世界中的基本原理和方法对这个二维的“平面世界”也适用。试回答:
。其中m相当于三维世界中的l和ms两者的作用(例如用它也能表示s、p、d……)。另外,在三维世界中的基本原理和方法对这个二维的“平面世界”也适用。试回答:
(1) 画出“平面世界”周期表中前四个周期。按照核电荷标明原子序数,并用原子序数(Z)当作元素符号(例如第一号元素的元素符号即为1),写出每个元素的电子构型。
(2) 现在研究n≤3的各元素。指出与“平面世界”中每种元素相对应的三维空间中的各种元素的符号。根据这种相似性,你估计在常温、常压下,哪些“二维世界”的单质是固体、液体和气体?
(3) 画图说明n = 2的“平面世界”元素的第一电离能的变化趋势。在“平面世界”周期表中,画出元素的电负性增长方向。
(4) 在这个“平面世界”中有哪些规则和三维世界中所用的8电子和18电子规则相当?
(5) n = 2的各元素分别与最轻的元素(Z = 1)形成简单的二元化合物。用原子序数作为元素符号;画出它们的路易斯结构式并画出它们的几何构型。指出分别与它们中每一个化合物相应的三维世界中的化合物。
6.1999年人是造元素丰收年,一年间得到第114、116和118号三种新元素。按已知的原子结构规律,第118号元素应是第 周期、第 族,它的单质在常温、常压下最可能呈现的状态是 态(气、液、固选一填入)。近日传闻俄国合成了第166号元素,若已知原子结构规律不变,该元素应是第
周期、第 族。
B
5.迄今已合成出的重元素第112号是用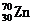 高能原子轰击
高能原子轰击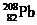 的靶子,使锌核与铅
的靶子,使锌核与铅
核熔合而得。科学家通过该放射性元素的一系列衰变的产物,确定了它的存在,总共只检出一个原子。该原子每次衰变都放出一个高能α粒子,最后得到比较稳定的第100号元素镄的含153个中子的同位素。
(1) 第112号元素应在周期表中第几周期、第几族?
(2) 它是金属元素、还是非金属元素?
(3) 你认为它的最高氧化态至少可以达到多少?
(4) 写出合成112元素的反应式(注:反应式中的核素要用诸如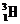 、
、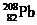 等带上
等带上
下标的符号来表示,112号元素符号未定,可用M表示。)
4.试根据原子结构理论预测:
(1) 第八周期将包括多少种元素?
(2) 原子核外出现第一个5g电子的元素的原子序数是多少?
(3) 第114号元素属于第几周期?第几族?
3.指出下列元素的名称和原子序数。并写出它们基态原子的核外电子排布式:
(1) 第八个稀有气体
(2) 第四周期中的第八个过渡元素
(3) 常温下为液态的非金属元素
(4) 熔点最低的金属元素
(5) 第六周期中的IVB族元素
(6) 4f层填入11个电子的元素
2.假定某星球上的元素服从下面量子数限制:
n
= 1,2,3……;l = 0,1,2……n-1;m = ±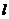 ;ms =
;ms = 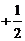 ,则该星球上前四个
,则该星球上前四个
惰性元素的原子序数分别为多少?
A
1.假定自旋量子数可取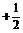 ,0,
,0,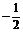 。若有关量子数的其他规则和各能级的填充顺序
。若有关量子数的其他规则和各能级的填充顺序
不变,问:
(1) s能级和p能级容纳电子数是多少?
(2) n = 2的能层可容纳多少电子?
(3) 原子序数为8和17的两个元素的电子构型各是什么?
20.写出下列在100%H2SO4中化学反应方程式
(1) HNO3(1mol) + H2SO4(2mol) υ* = 4
(2) H3BO3(1mol) + H2SO4(6mol) υ* = 6
(3) I2(7mol) + HIO3(1mol) + H2SO4(8mol) υ* = 16
υ*表示反应方程式右边的离子数(以mol计,可由冰点测定仪确定)
19.配合物的阴离子[ FeCl4- ]呈黄色,而[ Fe2Cl6 ]呈淡红色,在1L POCl3或PO(OR)3中溶解0.1mol FeCl3(s)得到一种淡红色溶液,该溶液稀释变为黄色,用Et4NCl滴定POCl3作溶剂的红色溶液,FeCl3/Et4NCl摩尔比为1∶1时颜色发生突变(由红变黄),振动光谱表明氧氯化物溶液与典型的Lewis酸通过氧配位的方式形成加合物。用两种可能的反应方程解释上述事实。
18.I2与S2O6F2之间可以进行化学计量控制反应
(1) 试写出I2∶S2O6F2=1∶3的化学反应方程式
(2) 试写出I2∶S2O6F2=3∶1的化学反应方程式
(3) 试写出I2∶S2O6F2=2∶1的化学反应方程式
(4) 上述反应属于哪种类型反应?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com