
8.生产高纯度氢氧化钠的离子交换膜电解槽,采用阳离子交换膜把阴极室和阳极室隔开。阳离子交换膜“只”允许阳离子通过。原料食盐水加入阳极区,未反应完的食盐水从阳极区取出,经精制后送回阳极室;从外部加水到阴极室以调节生成的烧碱液浓度并取出。和隔膜法相比,离子交换膜电解槽有以下特点:
(1) 得到高纯度的固体烧碱(含杂质NaCl 0.1%以下,NaClO3极微量,隔膜法产品含上列杂质量分别为1.0~1.2%和0.1~0.3%);
(2) 得高浓度的烧碱液(含NaOH 35~48%;隔膜法产品含NaOH约10%),大大降低了用于蒸发浓缩的能量消耗;
(3) 要求高浓度的原料食盐水中所含钙、镁等金属离子的总量控制在0.1ppm以下。
请根据食盐水电解的两极反应和副反应、离子迁移和放电及上述两种膜(交换膜和隔膜)的性能,简单说明离子交换膜电解槽具有上述特点的原因。
7.二氧化钛在现代社会里有广泛的用途。它的产量是一个国家国民经济发展程度的标志。我国至今产量不足,尚需要进口二氧化钛。硫酸法生产二氧化钛的简化流程框图如下(注钛铁矿的化学式为FeTiO3):
(1) 指出在上面的框图的何处发生了化学反应,并写出配平的化学方程式。
(2) 硫酸法生产二氧化钛排出的废液直接排放,将对环境有哪些不利的影响?请指出三点。
(3) 提出一种处理上述流程的废水的方法。
(4) 氯化法生产二氧化钛是以金红石(TiO2)为原料,氯气可以回收、循环使用。你能写出有关的化学方程式吗?请对比硫酸法和氯化法的优缺点。

6.矿泉水一般是由岩石风化后被地下水溶出其可溶部分生成的。风化作用是指矿物与水和CO2同时作用的过程。例如以下三种矿物风化成高岭土[Al2Si2O5(OH)4]的反应为:钾长石 KAlSi3O8 + H2CO3 + H2O ® K+ + HCO3- + H4SiO4 + Al2Si5(OH)4;黑云母 KMg3AlSi3O10(OH)2 + H2CO3 + H2O ® K+ + Mg2+ + HCO3- + H4SiO4 + Al2Si5(OH)4;中长石 Na0.5Ca0.5Al1.5Si2.5O8 + H2CO3 + H2O ® Na+ + Ca2+ + HCO3- + H4SiO4 + Al2Si5(OH)4。
(1) 配平以上三个反应方程式。
(2) 为什么这些反应能够发生?
(3) 为什么这些矿物风化后,Al没有象Na、K、Mg那样溶出?
(4) 有一种矿泉水,它相当于由0.20´10-4 mol钾长石,0.15´10-4 mol黑云母和1.2´10-4 mol中长石,风化后可溶成分溶于1升水中。并且每升水中另有从大气漂浮物中溶入的0.40´10-4 mol NaCl和0.26´10-4 mol Na2SO4。计算这种矿泉水中Na+、Ca2+、Mg2+、K+、HCO3-、SO42-、Cl-及H4SiO4的浓度(以mol·L-1表示)。
5.保险粉是Na2S2O4的工业俗名。它的年产量高达30万吨,是产量最大的人造无机盐之一。大量用于漂白纸张、纸浆和陶土以及印染。生产保险粉的方法之一是:先把甲酸(HCOOH)和溶于甲醇和水的混合溶剂的NaOH混合,再通入SO2气体,就得到保险粉。回答下列问题:
(1) 写出甲酸法生产保险粉 的配平的化学方程式。你认为此法中的甲醇的作用是什么?为什么?
(2) 保险粉的重要工业应用之一是瓮染。瓮染的燃料必须先在烧碱溶液里跟保险粉反应,所得的产物才会和棉纤维结合,然后织物经漂洗后再把反应产物回复到原来的染料。下面是一种瓮染法的蓝色染料的结构式:
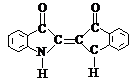
(a) 写出该蓝色染料和保险粉反应得到的产物的可能结构式。说明理由。
(b) 为什么必须令染料跟保险粉反应,才能使染料和织物结合?扼要地描绘结合的机理。
(c) 为什么最后还要把反应产物回复到染料原来的形态?该怎样回复?
(3) 保险粉的用途之一是除去废水中的CrO42-。据说这是迄今除去中性或碱性废水里的CrO42-的最有效的方法。往废水里通SO2不能达到此目的。试写出配平的离子方程式。
(4) 研究人员已经使用和正在研究用其它工业原料和SO2反应反应来制取保险粉。例如,使用NaBH4已经达到工业生产的规模(pH = 5~6)。你能写出该反应的离子方程式吗?
(5) 根据你所学的化学知识,还能想到其它几种生产保险粉的更廉价的原料吗?
4.随着医药、化学工业的发展,钯碳催化剂的用量日益增多,随之废钯催化剂也越来越多。据分析,废钯催化剂中含钯5-6%,碳93-94%,铁1-2%,铜0.1-0.2%以及锌、镍等金属和杂质,故钯碳具有很高的回收价值。
由废钯催化剂(也称钯碳)制取氯化钯的工艺过程主要包括:钯碳焚烧、王水溶解,氨水除铁,酸析(钯的氨配合物遇到稀盐酸能析出黄色结晶Pd(NH3)2Cl2),焙烧(550℃)等。
¯物料名称
(1) 试以框图(即方块图,例如 操作过程名称
操作过程名称 )形式绘出由钯碳制取氯化钯的工艺流程图。并指出流程中何步操作对提高钯的回收率是十分必要的,依据是什么?
)形式绘出由钯碳制取氯化钯的工艺流程图。并指出流程中何步操作对提高钯的回收率是十分必要的,依据是什么?
(2) 写出王水溶解的化学反应式。
(3) 试述氨水除铁的实验条件以及如何检验溶液中Fe3+离子是否除净。
(4) 试述550℃条件下焙烧的作用。
3.分散质微粒的直径大小在1~100nm之间的分散系叫做胶体。胶体化学法是制备纳米粒子的重要方法之一,其关键是“促进成核、控制生长”。用该法制备纳米Cr2O3的过程如下:CrCl3溶液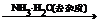 Cr2O3×xH2O沉淀
Cr2O3×xH2O沉淀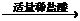 Cr2O3×xH2O水溶胶
Cr2O3×xH2O水溶胶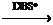 啊
啊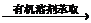 Cr2O3有机溶胶
Cr2O3有机溶胶 啊
啊 纳米Cr2O3
纳米Cr2O3
(DBS*:十二烷基苯磺酸钠)
回答下列问题:
(1) 加稀盐酸起什么作用?盐酸加多了或加少了将会怎样影响Cr2O3的产率?
(2) 为什么形成Cr2O3水溶胶可以阻止粒子长大?
(3) 用示意图描绘Cr2O3胶粒加DBS所得产物的结构特征。
(4) 为什么有机溶剂可以把“氧化铬”萃取出来?萃取的目的是什么?
(5) DBS直接排入水体会给环境造成何种影响(举1~2点)?已知DBS能够进行生物降解,其降解的最终产物是什么?
2.某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2 含量³65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:ZnS含量³80%,FeS、CuS、CdS含量各约2%,SiO2含量约7%,其余为水分。
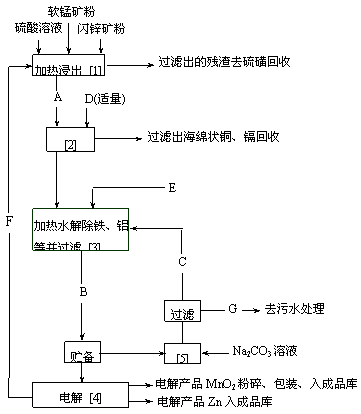
科研人员开发了综合利用这两种资源的工艺,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产正常时,只需外购少量硫酸和纯碱,其它原料则由内部解决。工艺流程框图如上图所示,流程框图中每一方框为一种处理过程,带箭头的线表示物流线。请阅图后回答下列问题:
(1) 写出图上标有阿拉伯数字的处理过程中发生的主要反应的化学方程式,并配平之。
(2) 写出A、B、C、D、E、F、G表示的物流线上全部物料的组分的化学式。
(3) 二氧化锰和锌是制造干电池的基本材料。电解二氧化锰的传统生产工艺主要为:软锰矿加煤还原焙烧;硫酸浸出焙烧料;浸出液经净化后去电解,电解时在阳极上析出二氧化锰(阴极产生的气体放空),获得的二氧化锰经粉碎后为成品。电解锌的传统生产工艺主要为:闪锌矿高温氧化除硫;焙烧渣用硫酸浸出;浸出液经净化后电解还原,在阴极获得电解锌(阳极产生的气体放空)。试从环境保护和能耗的角度,对比新工艺与传统工艺,指出新工艺的特点,并简单评述之。
1.A的单质和B的单质在加热下激烈反应,得到化合物X。X的蒸汽密度是同温度下的空气密度的5.9倍。X遇过量的水激烈反应,反应完全后的混合物加热蒸干,得一难溶物,后者在空气中经1000 0C以上高温灼烧,得到化合物Y。Y的一种晶体的晶胞可与金刚石晶胞类比。A原子的位置相当于碳原子在金刚石晶胞中的位置,但Y晶胞中A原子并不直接相连,而是通过E原子相连,X与过量氨反应完全后得到含A的化合物Z,Z在无氧条件下经高温灼烧得到化合物G。G是一种新型固体材料。
(1) 写出X的化学式;(2) 写出Y的化学式;(3) 写出Z的化学式;(4) 写出G的化学式;(5) 你预计G有什么用途?用一两句话说明理由。
11.酶促反应的历程可描述为:
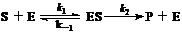
式中S为底物,E为酶,ES为S和E形成的复合物,P为产物;k1,k-1和k2为基元反应的速率常数。
酶促反应的速率r可用底物浓度c(S)的函数表示:
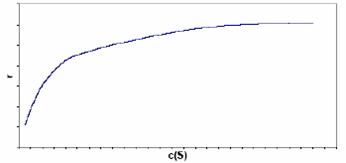
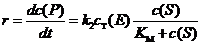
式中t为时间,c(P)为产物的浓度,cT(E)为酶的总浓度,而KM = (k-1 + k2)/k1。
(1) 确定下列速率方程中的变量x,y和z:
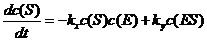
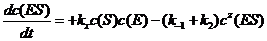
(2) 完成下列速率方程:
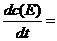
用β-内酰胺酶水解底物青霉素(底物)。当酶的总浓度为10-9 mol·L-1时,记录的数据如下图所示:
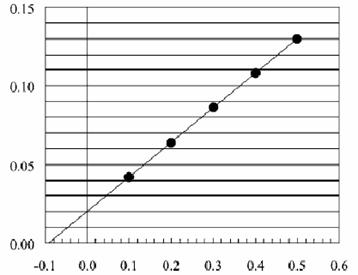
图中x 轴为:c-1(S) / (106L·mol-1);y 轴为:r -1/ (106L·min·mol-1)
(3) 确定常数k2和KM。设c(S) = 0.01·KM,复合物ES的浓度多大?
竞争抑制剂I可与底物竞争而阻断酶的活性点位: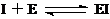
(4) 设EI的解离常数为9.5·10-4mol·L-1,酶的总浓度为8·10-4mol·L-1,为在无底物时,阻断50%的酶,抑制剂的浓度需多大?
(5) 以下表述是正确的还是错误的?
① 酶促反应的速率r 会因竞争抑制剂的存在而减小。
② 速率r 的最大值会因竞争抑制剂的存在而减小。
③ 底物S的浓度不会受到竞争抑制剂的影响。
④ 酶促反应的活化能会因竞争抑制剂的存在而加大。
在较详尽的酶促反应描述中,包括了产物变回底物的逆反应。最后,底物与产物之间达成一个化学平衡。
(6) 以下的表述哪些是正确的,哪些是错误的?
① 反应产物的平衡浓度会随底物浓度的增大而增大。
② 产物的平衡浓度会随酶的浓度增大而增大。
③ 速率常数k2越大,产物的平衡浓度越大。
10.在上世纪初,无色气体乙烯还是一种没有任何实用价值的稀罕的化学物质,现如今,乙烯的产量极大,2001年在德国乙烯的人均占有量已达60kg。用催化剂,乙烯能转化为乙烷。以氧化锌为催化剂的该反应慢得足以分析其反应历程。下图给出了乙烯氢化的反应历程(忽略了电荷和反应的计量系数)。
(1) 给出各步反应的顺序号,确定其正确的级数。
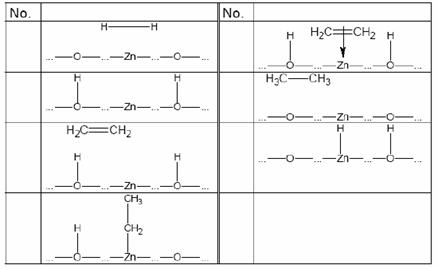
用θ(H)表示氢原子在表面位点上占有的分数;θ(C2H2)表示乙烯分子在表面位点上占有的分数;θ(C2H5)表示被吸附的中间物在表面点位上占有的分数。
(2) 设被吸附的中间物的氢化是最慢的反应,以下哪一速率方程是正确的?
① r = k · θ(H) ② r = k · θ(C2H4)
③ r = k · θ(H)· θ(C2H4) ④ r = k · c(H)· θ(C2H5)
水会阻断氧化锌催化的乙烯氢化反应。
(3) 仿照(1)问给出的图式写出水和催化剂相互作用的反应历程,解释这种阻断作用。用金属催化烯烃氢化时,会发生烯烃异构化的副反应。当D2与1-丁烯反应时,将生成1和2两种副产物。
(4) 完成下列反应图式,写出中间物的结构。

气体分子在表面点位吸附的分数(θ)可简单地用朗格缪尔等温方程描述:
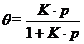
式中p为气体的压力,K为吸附-脱附平衡常数。
(5) 设有2种或更多种气体在催化剂表面上吸附,写出气体i在表面点位上占有分数θ(i)的相应方程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com