
21.
(1) 。
(2)
(3) 。
(4)
22
. (1)_________________________________。
(2) ,
_ 。
(3)
______________________________________ ,_______________________________________ _。
25.在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为: C2O42-+MnO4-+H+→CO2↑+Mn2++H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算,得高锰酸钾的物质的量浓度。试回答下列问题:
(1)配平反应方程式: C2O42-+ MnO4-+ H+→ CO2↑+ Mn2++ H2O
(2)该滴定实验 (“需要”或“不需要”)加指示剂。
(3)步骤二中滴定操作图示正确的是__________(填编号)。

(4)步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________ ,最后又变慢的原因是 。
(5)请写出步骤三的操作内容 。
(6)若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol·L-1。
|
余姚中学 高三化学第一次质量检测答卷
24.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式
。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
23.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+ 对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
22.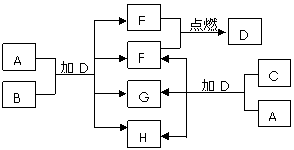 下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
下列框图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素。B、E、F为单质。常温常压下D为液体,E、F为气体,F是空气的主要成分之一。C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A~H有可能发生如下转化,其反应关系如图所示:
(1)写出E+F→D的化学反应方程式:
_________________________________。
(2)B的化学式 , A的电子式 。
(3)如上图所示,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为:
______________________________________,________________________________________。
21. 氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40-50℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生反应是2Cu+ = Cu2+ + Cu ,根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 (填氧化剂或还原剂) 。
(2)写出CuH在氯气中燃烧的化学反应方程式 。
(3)CuH溶解在稀盐酸中生成的气体是 (填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中只生成NO气体,请写出CuH溶解在足量稀硝酸中反应的化学方程式
20.常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(Na+)= c(CO32-)+c(HCO3-)+ c(H2CO3)
B.0.1mol·L-1的NH4Cl溶液与0.1mol·L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)=c(Na+)>c(NH4+)>c(OH-)>c(H+)
C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:CH3COO-离子浓度前者大于后者的10倍
D.pH=11的Na2CO3溶液中:c(Na+) - 2c(CO32-) - c(HCO3-) = 10-3 - 10-11
19.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+ .下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
18.
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.4×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.5×10-16 |
下列说法不正确的是
A.五种物质在25℃时溶解度(mol·L-1)最大的是Ag2SO4
B.在氯化银的悬浊液中加入Na2S溶液则可以生成黑色的Ag2S
C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积和溶解度都相同
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
17.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3; ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com