
4.下列各句中没有语病的一句是 ( )
A.目前这场席卷全球的经济危机,正在使世界经济形势发生逆转,种种迹象表明,这是一场在规模、深度和复杂性等方面都史无前例的大危机。
B.由于自身特殊情况,美术、体育等特长生在专业上多投入一点时间和精力本是无可非议的,但是是否就可以因此而忽视文化课的学习呢?从长远的观点看,我们认为这样做是不恰当的。
c.金鸡鞋油系列产品包括:金鸡膏体鞋油、金鸡液体鞋油、金鸡高级鞋蜡、金鸡皮革护理剂及金鸡地板蜡。
D.有些炎症,西药中药都能治。不但中约能与一般抗菌素媲美,而且副作用小,成本也较低。
3.下列各句中加点的成语使用恰当的一句是 ( )
A.近年来,东平县将生态理念贯穿于经济社会发展,关停污染企业,使东平湖区生态环境逐渐改善,水产资源日渐丰富,这里又恢复了往日风声鹤唳、飞鸟成群的景象。
B.巴黎市长下令在市政厅前方挂起“巴黎支持世界各地的人权”的巨幅标语,其险恶用心昭然若揭,总统萨科齐宣称不参加北京奥运会开幕式,其态度也不言白明。
C.冯小刚把《集结号》中最重要的角色给了谷志鑫,其他的人反而成了举重若轻的角
色。
D.前不久,台湾《壹周刊》报道了前领导人陈水扁密汇新台币3亿元出境洗钱的事件,人们纷纷街谈巷议这一空前的丑闻。
2.依次填入下面横线处的词语,恰当的一组是 ( )
①为表达全国各族人民对四川汶川大地震 同胞的深切哀悼,国务院决定,2008年5月19日至21日为全国哀悼日。
②季羡林先生治学严谨,为了弄清每句话的出处,判断对方说法的真伪,他跑了好儿家图书馆, 了大量的文献资料。
 ③中国社科院民族研究所所长助理扎洛说,包括西藏在内的各藏区 不是一个单纯的藏族聚居区,从经济生活形态上来讲,藏民与其他各民族是互补的。
③中国社科院民族研究所所长助理扎洛说,包括西藏在内的各藏区 不是一个单纯的藏族聚居区,从经济生活形态上来讲,藏民与其他各民族是互补的。
A.遇害 批阅 历来 B.遇害 披阅 历米
C.遇难 披阅 从来 D.遇难 批阅 从米
1.下列各组词语中错别字最多的一项是 ( )
A.貌和神离 殒身不恤 针砭时弊 各行其事
B.泾渭分明 无礼取闹 好高骛远 曲指可数
C.墨守成规 一愁莫展 黔驴技穷 闲情逸志
D.返璞归真 舐牍情深 两全齐美 篷荜生辉
A.  B.
B.  C.
C.  D.
D.  4.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列粒子的物质的量浓度关系正确的是(
)
A.
4.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列粒子的物质的量浓度关系正确的是(
)
A. 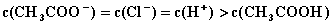 B.
B. 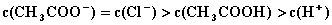 C.
C. 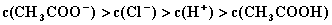 D.
D. 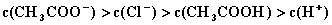 5.可逆反应
5.可逆反应 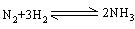 的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.
的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 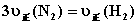 B.
B. 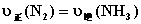 C.
C. 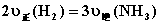 D.
D. 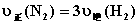 6.还原
6.还原 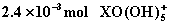 到X元素的低价态时,消耗0.2mol/L的Na2SO3溶液30mL,则X元素的低价态是( )
A.+1
B.
到X元素的低价态时,消耗0.2mol/L的Na2SO3溶液30mL,则X元素的低价态是( )
A.+1
B.
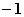 C.0 D.
C.0 D. 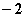 7.在含有酚酞的0.1mol/L氨水中加入少量NH4Cl晶体,则溶液颜色(
)
A.变蓝色 B.变深 C.变浅 D.不变
8.已知铅蓄电池放电时的电极反应为
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
若用此电池作电源电解饱和食盐水(惰性电极),当阴、阳极上收集到的气体总体积为1.68L(标准状况下)时,该蓄电池内消耗H2SO4的物质的量至少是( )
A.0.4mol B.0.2mol C.0.15mol D.0.075mol
二、选择题
9.下列叙述正确的是( )
A.同周期非金属元素的原子半径越小.其单质的沸点越高
B.同周期元素的离子,核电荷数越大半径越大
C.同周期主族元素的原子半径越大,其原子越易失去电子
D.同周期非金属元素的原子半径越大,其气态氢化物越稳定
10.1mol
X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应
7.在含有酚酞的0.1mol/L氨水中加入少量NH4Cl晶体,则溶液颜色(
)
A.变蓝色 B.变深 C.变浅 D.不变
8.已知铅蓄电池放电时的电极反应为
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
若用此电池作电源电解饱和食盐水(惰性电极),当阴、阳极上收集到的气体总体积为1.68L(标准状况下)时,该蓄电池内消耗H2SO4的物质的量至少是( )
A.0.4mol B.0.2mol C.0.15mol D.0.075mol
二、选择题
9.下列叙述正确的是( )
A.同周期非金属元素的原子半径越小.其单质的沸点越高
B.同周期元素的离子,核电荷数越大半径越大
C.同周期主族元素的原子半径越大,其原子越易失去电子
D.同周期非金属元素的原子半径越大,其气态氢化物越稳定
10.1mol
X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应 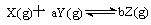 。反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是(
)
A.a=1,b=1
B.a=2,b=1
C.a=2,b=2
D.a=3,b=2
11.下列反应的离子方程式不正确的是( )
A.钠跟水反应:
。反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是(
)
A.a=1,b=1
B.a=2,b=1
C.a=2,b=2
D.a=3,b=2
11.下列反应的离子方程式不正确的是( )
A.钠跟水反应: 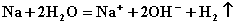 B.硫化亚铁跟稀硫酸反应:
B.硫化亚铁跟稀硫酸反应: 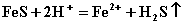 C.氯气通入烧碱溶液:
C.氯气通入烧碱溶液: 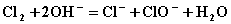 D.向氢氧化钡溶液中滴加硫酸氢钾溶液至中性:
D.向氢氧化钡溶液中滴加硫酸氢钾溶液至中性: 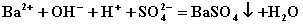 12.原子序数为47的银元素有两种天然同位素,它们所占的原子百分比近似相等。已知银元素的近似平均相对原子质量为108,则两种同位素原子中的中子数分别为( )
A.110和106 B.57和63 C.60和62 D.53和73
13.下列各分子中所有原子均满足最外层8电子结构的是(
)
A.PCl5
B.P4 C.CCl4 D.NH3
14.某元素X的原子核外电子数等于核内中子数。取2.8g此元素的单质与氧气充分反应,可得6gXO2。
有关元素X的说法正确的是( )
A.X位于周期表中第二周期VA族
B.X位于周期表中第三周期ⅣA族
C.XO2晶体熔点高,硬度大
D.X的气态氢化物的水溶液呈强酸性
15.以NA表示阿伏加德罗常数值,下列说法正确的是( )
A.1L0.1mol/L的醋酸溶液中含离子和分子总数是0.1NA
B.2gD2O所含中子数为NA
C.1.6gNH2-离子中所含电子数为NA
D.22.4L氖气中所含原子数为NA
16.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:
X(g)+2Y(g)
12.原子序数为47的银元素有两种天然同位素,它们所占的原子百分比近似相等。已知银元素的近似平均相对原子质量为108,则两种同位素原子中的中子数分别为( )
A.110和106 B.57和63 C.60和62 D.53和73
13.下列各分子中所有原子均满足最外层8电子结构的是(
)
A.PCl5
B.P4 C.CCl4 D.NH3
14.某元素X的原子核外电子数等于核内中子数。取2.8g此元素的单质与氧气充分反应,可得6gXO2。
有关元素X的说法正确的是( )
A.X位于周期表中第二周期VA族
B.X位于周期表中第三周期ⅣA族
C.XO2晶体熔点高,硬度大
D.X的气态氢化物的水溶液呈强酸性
15.以NA表示阿伏加德罗常数值,下列说法正确的是( )
A.1L0.1mol/L的醋酸溶液中含离子和分子总数是0.1NA
B.2gD2O所含中子数为NA
C.1.6gNH2-离子中所含电子数为NA
D.22.4L氖气中所含原子数为NA
16.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:
X(g)+2Y(g) 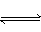 2Z(g)。此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1molX同时生成0.2mol Z
17.下列晶体熔化时化学键没有被破坏的是( )
A.冰醋酸 B.NaCl C.金刚石 D.SiO2
18.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子次外层电子数等于其原子核外电子总数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A
B.D>B>A>C
C.A>D>C>B
D.B>A>C>D
三、(本题包括2小题)
19.CaCO3是难溶于水的强电解质,它在水中存在溶解平衡:
2Z(g)。此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1molX同时生成0.2mol Z
17.下列晶体熔化时化学键没有被破坏的是( )
A.冰醋酸 B.NaCl C.金刚石 D.SiO2
18.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子次外层电子数等于其原子核外电子总数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A
B.D>B>A>C
C.A>D>C>B
D.B>A>C>D
三、(本题包括2小题)
19.CaCO3是难溶于水的强电解质,它在水中存在溶解平衡: 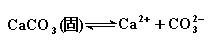 若在有CaCO3粉末的水中不断通入CO2为什么能使CaCO3溶解? ____________________________________
20.
(1)用于检查司机是否酒后驾驶的装置中放有用硅胶吸附了橙红色的强氧化剂K2Cr2O7,遇到酒精蒸气时则被还原成Cr3+而改变颜色。
①配平下列化学方程式:
口K2Cr2O7+口CH3CH2OH+口H2SO4=口K2SO4+口Cr2(SO4)3+口CH3COOH+口H2O
②在H2O2中加入乙醚后,再滴入酸性K2Cr2O7溶液,振荡后静置,可在乙酸中得到蓝色CrO5(结构式为
若在有CaCO3粉末的水中不断通入CO2为什么能使CaCO3溶解? ____________________________________
20.
(1)用于检查司机是否酒后驾驶的装置中放有用硅胶吸附了橙红色的强氧化剂K2Cr2O7,遇到酒精蒸气时则被还原成Cr3+而改变颜色。
①配平下列化学方程式:
口K2Cr2O7+口CH3CH2OH+口H2SO4=口K2SO4+口Cr2(SO4)3+口CH3COOH+口H2O
②在H2O2中加入乙醚后,再滴入酸性K2Cr2O7溶液,振荡后静置,可在乙酸中得到蓝色CrO5(结构式为 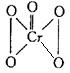 )。则CrO5中氧元素的化合价为_________。
(2)有甲、乙两份等体积的浓度均为0.1mol/L的氨水,pH=11。
①将甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡向_____(填“促进”或“抑制”)电离的方向移动,溶液的pH将变为________。(填序号)
A.9-10之间
B.11
C.12-13之间
D.13
②将乙用0.1mol/L的NH4Cl溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液比较,甲的pH(填“大于”、“小于”或“等于”)乙,其原因是__________________。
四、(本题包括2小题)
21.
I.恒温、恒压下,在一个可变容积的容器中发生如下反应:
)。则CrO5中氧元素的化合价为_________。
(2)有甲、乙两份等体积的浓度均为0.1mol/L的氨水,pH=11。
①将甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡向_____(填“促进”或“抑制”)电离的方向移动,溶液的pH将变为________。(填序号)
A.9-10之间
B.11
C.12-13之间
D.13
②将乙用0.1mol/L的NH4Cl溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液比较,甲的pH(填“大于”、“小于”或“等于”)乙,其原因是__________________。
四、(本题包括2小题)
21.
I.恒温、恒压下,在一个可变容积的容器中发生如下反应:  (1)若开始时放入1molA和1molB,到达平衡后.生成a
mol C,这时A的物质的量为_______mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为_______mol。
(3)若开始时放入xmolA,2molB和1molC,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x=____mol,y=_____mol。
平衡时,B的物质的量_______。(选填一个编号)
甲.大于2mol 乙.等于2mol
丙.小于2mol 丁.可能大于、等于或小于2mol
作出此判断的理由是___________________________________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是__________。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较_______。(选填一个编号)
甲.a<b 乙.a>b
丙.a=b 丁.不能比较a和b的大小
作出此判断的理由是____________________________________________________。
22.有原子序数依次增大的A、B、C、D、E、F六种短周期元素,它们可两两组成甲、乙、丙、丁、戊五种化合物,各化合物中原子个数比关系如下:
甲 乙 丙 丁 戊
A:D=2:1 B:D=1:2 E:C=3:2 E:F=1:2 B:F=1:4
其中A、B两种元素的原子核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;B、C和D为同周期相邻元素,E和F位于同一周期,且二者原子序数之和为29。
(1)写出甲、丙、丁、戊四种物质的化学式:甲_______,丙_______,丁_______,戊_______。
(2)乙的电子式为_______,戊的用途是(两项)_______。
(3)E、B元素可构成化合物E2B3,它具有碳化物(如CaC2)的性质,则E2B3与水反应的化学方程式为:_______。
五、(本题包括2小题)
23.如图2中a、b、c、d均为铂电极,供选择的4组电解质溶液如下表:
(1)若开始时放入1molA和1molB,到达平衡后.生成a
mol C,这时A的物质的量为_______mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为_______mol。
(3)若开始时放入xmolA,2molB和1molC,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x=____mol,y=_____mol。
平衡时,B的物质的量_______。(选填一个编号)
甲.大于2mol 乙.等于2mol
丙.小于2mol 丁.可能大于、等于或小于2mol
作出此判断的理由是___________________________________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是__________。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较_______。(选填一个编号)
甲.a<b 乙.a>b
丙.a=b 丁.不能比较a和b的大小
作出此判断的理由是____________________________________________________。
22.有原子序数依次增大的A、B、C、D、E、F六种短周期元素,它们可两两组成甲、乙、丙、丁、戊五种化合物,各化合物中原子个数比关系如下:
甲 乙 丙 丁 戊
A:D=2:1 B:D=1:2 E:C=3:2 E:F=1:2 B:F=1:4
其中A、B两种元素的原子核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;B、C和D为同周期相邻元素,E和F位于同一周期,且二者原子序数之和为29。
(1)写出甲、丙、丁、戊四种物质的化学式:甲_______,丙_______,丁_______,戊_______。
(2)乙的电子式为_______,戊的用途是(两项)_______。
(3)E、B元素可构成化合物E2B3,它具有碳化物(如CaC2)的性质,则E2B3与水反应的化学方程式为:_______。
五、(本题包括2小题)
23.如图2中a、b、c、d均为铂电极,供选择的4组电解质溶液如下表:
|
组 |
A |
B |
C |
D |
|
甲槽 |
NaOH |
AgNO3 |
H2SO4 |
NaCl |
|
乙槽 |
CuSO4 |
CuCl2 |
AgNO3 |
AgNO3 |
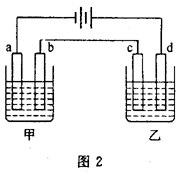
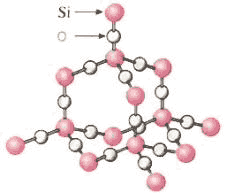
要满足的条件是: (1)工作一段时间后,甲槽电解液pH上升.而乙槽电解液pH下降;(2)b、c两极放电离子的物质的量相等。 则(1)应选用的电解液是________组。 (2)甲槽的电解方程式为______________________________。 乙槽的电解方程式为______________________________。 24.二氧化硅晶体是立体的网状结构。其晶体模型如图3。认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小环为______元环。 (2)每个最小环平均拥有______个氧原子。 六、(本题包括2小题) 25.电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。 现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol/LAgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀。请计算: (1)溶液A中FeCl3的物质的量浓度为________________; (2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于______; (3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填入下表:
|
剩余固体的组成 |
m的取值范围 |
n的取值范围 |
|
只有铜 |
|
|
|
有铁且有铜 |
|
(用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为_________mol/L。 26.(11分)有一硝酸盐晶体,化学式为M(NO3)x·nH2O,经测定其摩尔质量为242g/mol。取1.21g此晶体溶于水,配制成100mL溶液。将其置于电解池中,用惰性材料为电极进行电解。当有0.01mol电子经过电极时,溶液中全部金属离子在电极上析出,经测定阴极增重0.32g。求: (1)1.21g此盐晶体的物质的量是多少?x值是多少? (2)M的原子相对质量和n值分别是多少? (3)如电解过程中溶液体积不变,电解结束后溶液的pH是多少?
22.(14分)已知集合A={x||x-a|<ax,a>0},若f(x)=sinπx-cosπx,在A上是单调递增的函数,求a的取值范围。
21.(14分)已知ΔABC的三边长a=7, b=3, c=8,长为4的线段PQ以点A为中点,记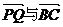 的夹角为θ,问当θ为何值时,
的夹角为θ,问当θ为何值时,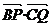 取得最值,其最值是多少?
取得最值,其最值是多少?
20.(12分)已知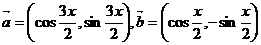 ,且
,且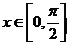
(1)求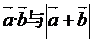 ;
;
(2)求函数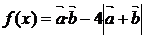 的最小值和最大值。
的最小值和最大值。
19.(12分)已知ΔABC的三个顶点为A(2,5), B(-2,2), C(5,1)
(1)求角∠BAC的角平分线AD的长;
(2)在BC边上有一点P,使得SΔABP:SΔABC=1:3,求点P的坐标。
18.(11分)在ΔABC中,角A、B、C的对边分别为a、b、c,2sin2C=3cosC,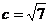 ,又ΔABC的面积为
,又ΔABC的面积为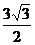 ,求:(1)角C的大小;(2)a+b的值。
,求:(1)角C的大小;(2)a+b的值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com