
14. (1)固体反应物的表面积; 表面积越大; 1和2(或4和5)。 (2)1、3、4、6、8;或2和5。 (3)反应温度; 6和7,8和9。 (4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。
13. (1)研究反应物I-与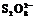 的浓度对反应速率的影响。
(2)29.3 s。 (3)A。
的浓度对反应速率的影响。
(2)29.3 s。 (3)A。
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
16.(05广东卷)
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(己知气体的分压之比等于物质的量之比)。
 ==0.00296 mol·L-1·s-1。 ==0.00296 mol·L-1·s-1。
③反应的c(N2O5)=×c(NO2)=×4.98mol·L-1= 2.475mol·L-1,剩余的c(N2O5)为2.525mol·L-1>2.48mol·L-1,说明反应速率比T1慢,即T2<T1。 (3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成。电极反应式见答案。 答案:(1) (2)①不变 ②0.00296 mol·L-1·s-1 ③“<”或“小于” (3)阴极;N2O4+2HNO3-2e-=2N2O5+2H+。 15.(05上海卷)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应: H2(g) + I2(g) ⇌ 2HI(g) + Q (Q>0) 反应中各物质的浓度随时间变化情况如图1: (1)该反应的化学平衡常数表达式为 。 (2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。 (3)反应达到平衡后,第8分钟时: ①若升高温度,化学平衡常数K (填写增大、减小或不变) HI浓度的变化正确的是 (用图2中a-c的编号回答) ②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答) (4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况 14.(07海南卷)下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题: (1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号); (2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号); (3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。 (4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________ ______________________________________________________。
13.(07广东卷)
“碘钟”实验中,3I-+
回答下列问题: (1)该实验的目的是___________________________________________________。 (2)显色时间t1=______________。 (3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。 (A)<22.0 s (B)22.0 s-44.0 s (C)>44.0 s (D)数据不足,无法判断 (4)通过分析比较上表数据,得到的结论是_________________________________________。 12.(08重庆卷)N2O2-是一种新型硝化剂,其性质和制备受到人们的关注. (1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。 (2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0 ①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。 ②下表为反应在T1温度下的部分实验数据:
则500 s内N2O5的分解速率为 。 ③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。 (3)如图所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 。
11.(04全国卷)在恒温恒容条件下,能使A(g)+B(g) A.减小C或D的浓度 B.增大D的浓度 C.减小B的浓度 D.增大A或B的浓度 10.(04上海卷)将ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将bg(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
9.(04全国卷)反应2SO2+O2 A.0.1s B.2.5s C.5s D.10s 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |