
9.下列说法中正确的是
A.△H>0kJ·mol-1表示放热反应,△H<0kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.室温时将pH=5的盐酸,稀释1000倍后,溶液pH约为8
8.能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的离子组是
A.Na+、H+、Cl-、NO3- B.Na+、Mg2+、Cl-、SO42-
C.K+、Ba2+、OH-、I- D.Cu2+、S2-、Br-、ClO-
7.下列说法中不正确的是
A.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
B.常温常压下,金属和酸反应,若生成2g 氢气,则有2mol电子发生转移
C.标准状况下,1L H2O约含有1/22.4 mol的H2O分子
D.常温常压下,1mol氮气含有阿伏加德罗常数个氮分子
6.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
① 根据酸电离产生H+的个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.①②⑤ B.②③ C.①②④ D.②③④⑤
29.(14分)碱存在下,卤代烃与醇反应生成醚(R-O-R′)
R-X + R′OH 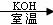 R-O-R′ + HX
R-O-R′ + HX
化合物A经下列四步反应得到常用溶剂四氢呋喃,反应框图如下:
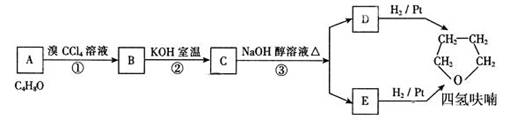
请回答下列问题:
(1)A物质中所含官能团的名称_________________________;
(2)写出①、③步反应类型分别为①____________、③____________;
(3)写出下列反应的化学方程式:
(I)A与乙酸反应________________________________________,
(II)A的一种同分异构体发生银镜反应_________________________________;
(4)写出四氢呋喃链状醚类的所有同分异构体的结构简式_____________________。
28.(16分)实验室制取氨与氨的有关性质实验会用到如下甲、乙、丙、丁四套装置:
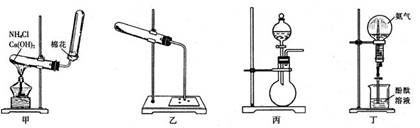
(1)实验室通常利用图甲所示的装置来制取氨。简述点燃酒精灯后给试管加热的操作过程__________________________________________,说明发生装置试管口略向下倾斜的原因________________________________;
(2)图乙点滴板(或玻璃片)的3个凹穴中分别滴入1滴浓盐酸、浓硝酸和浓硫酸。然后加热NH4Cl和Ca(OH)2的混合物,当有氨放出时,移动点滴板,使导管口对准不同的酸。简述观察到的主要现象___________________________________________;
(3)实验室利用图丙所示的装置也可制取氨,指出所用的药品为__________________,利用相关化学原理解释产生氨的理由__________________________________________;
(4)某学生欲用图丁装置进行喷泉实验,结果失败,试分析失败的可能原因(填至少3个要点)________________________________________________________;
(5)若某学生用图丁装置成功进行了喷泉实验,已知烧瓶中用排空气法收集到的氨气(标准状况下)相对H2的密度为9,则理论上得到氨水的物质的量浓度约为_______mol/L.
27.(15分)A、B、C、D是中学化学常见单质,其中C、D是金属,构成它们的元素的原子序数分别为a、b、c、d,且2(a+b)=3(c-a);X、Y、Z、M、N、W、H、K是常见化合物,M为白色沉淀,它们之间有如下转化关系(图中反应物和生成物中的H2O已略去)
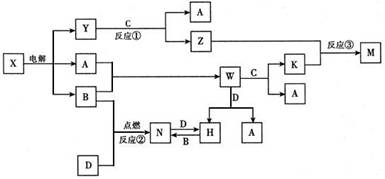
回答下列问题:
(1)写出M的化学式____________________;
(2)指出元素D在元素周期表中的位置________________________;
(3)C、D与Y的浓溶液能形成原电池,写出负极的电极反应式_____________________________;
(4)写出反应③的离子方程式____________________________________________;
(5)25时,pH=5的W和N的水溶液中,由水电离出来的c(H+)浓度之比为_____________。
26.(15分)
已知甲、乙、丙、丁、戊五种微粒为短周期元素形成的粒子,它们的电子总数都为18,请回答下列问题:
(1)甲为双核分子,可与水发生置换反应,写出其化学方程式__________________________;
(2)乙为两种元素形成的双核离子,含该离子的水溶液中加入适量氯水出现浑浊,写出该反应的离子方程式________________________________;
(3)丙为含两种元素的分子,且原子个数比为1:1,其水溶液呈弱酸性,写出其主要的电离方程式________________________________;
(4)丁为六原子分子,人误饮少量丁能使人眼睛失明,写出丁的电子式______________;
(5)戊属于烃,已知1g戊在空气中完全燃烧放出52kJ的热量,写出戊的燃烧的热化学方程式_________________________________________。
13.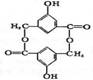 一环酯化合物结构简式如图,下列说法符合实际的是
一环酯化合物结构简式如图,下列说法符合实际的是
A.其水解产物能使FeCl3溶液变色
B.该化合物所有的原子都在同一平面上
C.与NaOH溶液反应时,1mol该化合物能消耗6mol NaOH
D.化学式为C16H10O6
第II卷(60分)
12. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol CuO,恰好恢复到电解前的浓度和pH。则电解过程中共转移电子的总物质的量为
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com