
1、有三个盛放葡萄糖液的密封瓶,已知一瓶混有酵母菌,一瓶混有乳酸菌,一瓶只有葡萄糖,下列叙述正确的是
A.有气泡的瓶子肯定混有酵母菌
B.发热的瓶子肯定混有乳酸菌
C.只盛放葡萄糖液的瓶子能量会增加
D.混有乳酸菌的瓶子物质种类会减少
9.(18分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中abcd表示止水夹)。请按要求回答下列问题:
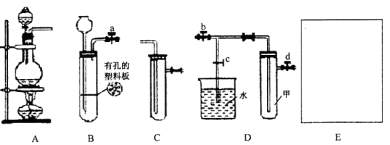
I.某同学用浓盐酸和MnO 加热反应抽取氯气时,需选用以上装置(填字母,除杂质和干燥装置略)__________________、C:还需补充装置E,请在右上方方框内装置简图,并标注其所盛药品的名称。若用此套实验装置比较Cl
加热反应抽取氯气时,需选用以上装置(填字母,除杂质和干燥装置略)__________________、C:还需补充装置E,请在右上方方框内装置简图,并标注其所盛药品的名称。若用此套实验装置比较Cl 和Br
和Br 的还原性强弱,需在装置C中盛装药品的名称是____________________________________
的还原性强弱,需在装置C中盛装药品的名称是____________________________________
II.用浓硝酸和铜片反应制备NO 气体时,应选用以上装置(填字母)
气体时,应选用以上装置(填字母)
发生反应的化学方程式为_________________________________________________ ___
(1)简述检验该装置气密性的方法: __________说明装置不漏气。
(2)欲用D装置验证试管甲中的NO 能与水(滴有石蕊试液)反应,其操作步骤为①关闭止水夹(填字母)_________,②打开止水夹(填字母)__________,③然后(填操作)__________________ ,至水中有气泡冒出;随后可观察到水倒流入试管甲,其中发生反应的化学方程式为__________________________________________________ _________
能与水(滴有石蕊试液)反应,其操作步骤为①关闭止水夹(填字母)_________,②打开止水夹(填字母)__________,③然后(填操作)__________________ ,至水中有气泡冒出;随后可观察到水倒流入试管甲,其中发生反应的化学方程式为__________________________________________________ _________
(3)欲使试管甲中收集满的NO (标准状况下)尽可能多地被水吸收,需要进行的操作是_______________。直至试管甲中全部充满水(假设水不外溢),所得溶液中溶质的物质的量浓度是
mol·L
(标准状况下)尽可能多地被水吸收,需要进行的操作是_______________。直至试管甲中全部充满水(假设水不外溢),所得溶液中溶质的物质的量浓度是
mol·L
 。
。
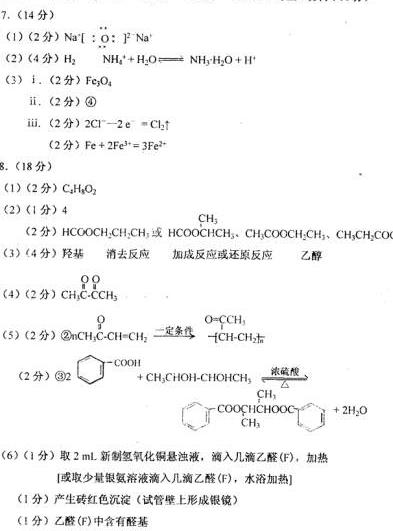

8.(18分)乙偶姻是一种重要的香料。已知乙偶姻中只含有C、H、O原子个数比为2:4:1。请按要求回答下列问题:
I(1 )乙偶姻的分子式为________________(2)X是乙偶姻的同分异构体,且X属于酯类,其结构简式可能有________种,请写出X的一种结构简式_______II与乙偶姻有关的反应如下:
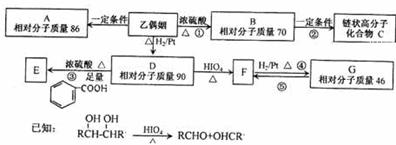 (3)乙偶姻除含有碳氧双键外,还含有的官能团名称是__________写出①④的反应类型_______
(3)乙偶姻除含有碳氧双键外,还含有的官能团名称是__________写出①④的反应类型_______
G的名称___________(4)A核磁共振氢谱仅有一种类型氢原子的吸收峰,其结构简式是_____(5)写出②③的化学反应方程式_________
(6)设计实验检验F中的官能团:___________操作方法_____________现象__________结论___________
7.(14分)现有部分短周期元素的性质、原子结构或物质用途如下表所述:
 (1)写出由元素X与W且仅含离子键的化合物的电子式:__________(2)Z单质的化学式为____________;含元素Z、Y的10电子阳离子的氯化物水溶液呈酸性,用离子方程式表示其原因:____________
(1)写出由元素X与W且仅含离子键的化合物的电子式:__________(2)Z单质的化学式为____________;含元素Z、Y的10电子阳离子的氯化物水溶液呈酸性,用离子方程式表示其原因:____________
(3)下图为几种中学常见的物质间的转化关系。其中C、D为气体单质;E为金属单质;其余均为化合物;A含X与W元素,B含Z与V元素。图中部分产物已略去。请按要求回答下列问题: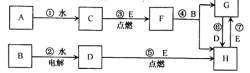 F的化学式为_______上图转化关系中不属于氧化还原反应的有(填编号)______按要求写出下列反应的方程式
F的化学式为_______上图转化关系中不属于氧化还原反应的有(填编号)______按要求写出下列反应的方程式
反应②中阳极反应式: ____________________________________
反应⑦的离子方程式:_____________________________________
10.

 (14分)
(14分)
(1) (2分)
(2)废弃物利用,有利于环保(答案合理均给分) (1分)
(3)①放热 (1分)
②增大 不变 (每空1分,共2分)
(4)(答案合理均给分,如图1或图2) (3分)
(5)C2H5OH + 3H2O-12e-== 2CO2 + 12H+ (2分)
(6)C2H4(g) + H2O(l)== C2H5OH(l);△H=-44.2 kJ @ mol-1 (3分)
训练五
9.(18分)1)圆底烧瓶 (2分)
 (2)
(2)
(没有尾气处理装置不扣分) (2分)
Cu + 4H+ + 2NO3-== Cu2+ + 2NO2↑+ 2H2O (2分)
(3)没有吸收圆底烧瓶中水蒸气的装置(或答CO2中混有的水蒸气也会被C吸收);干燥管与空气相通,空气中的CO2和水蒸气也会被吸收;反应结束后,装置内残留的CO2不能完全排除;等等。(答案合理均给分) (每空1分,共2分)(4)①过氧化钠 (2分)过氧化钠与浓氨水中的H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使氨的溶解度减小而逸出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出 (2分)
 ②还原性
(2分)
②还原性
(2分)
4NH3 + 5O2 ===== 4NO + 6H2O 2NO + O2 == 2NO2 (各2分,共4分)
8. (18分)
(18分)
 (1)
(2分) 是(1分)
(1)
(2分) 是(1分)
(2) (2分)
(3)消去反应、加成反应、取代反应(或水解反应) (每空1分,共3分)
 (4)
2,3-二甲基-1,3-丁二烯
(每空2分,共4分)
(4)
2,3-二甲基-1,3-丁二烯
(每空2分,共4分)

 (5)CH2=CHCH2CH3
CH2=C(CH3)2
(5)CH2=CHCH2CH3
CH2=C(CH3)2
(每空1分,共4分)
 (6)
(6)
(2分)
10.(14分)乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g) + 6H2(g) === CH3CH2OH(g) + 3H2O(g) (1)写出该反应的平衡常数表达式:K=_________________________(2)请说明以CO2为原料合成乙醇的优点是_________________(只要求写出一条)。(3)在一定压强下,测得该反应的实验数据如下表:

|
500 |
600 |
700 |
800 |
||
|
1.5 |
45 |
33 |
20 |
12 |
||
|
2.0 |
60 |
43 |
28 |
15 |
||
|
3.0 |
83 |
62 |
37 |
22 |
 ①
该反应是___________反应(填“吸热”或“放热”)。② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率_______;平衡常数K_________。(填“增大”、“减小”、或“不变”)
①
该反应是___________反应(填“吸热”或“放热”)。② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率_______;平衡常数K_________。(填“增大”、“减小”、或“不变”)
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含
义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳。
该电池的负极反应式为: ___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式___________________________
9.(18分)图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。
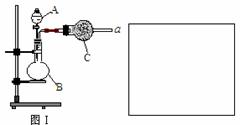 (1)图Ⅰ中仪器B的名称:_______________________。
(1)图Ⅰ中仪器B的名称:_______________________。
(2)同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图。B中发生反应的离子方程式为____________________________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:①__________________________________;②________________________________。
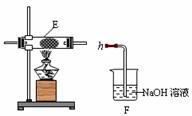
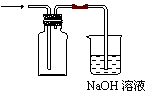
 (4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器a b c h。 ①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是________________②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的化学方程式为_______________
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器a b c h。 ①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是________________②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的化学方程式为_______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com