
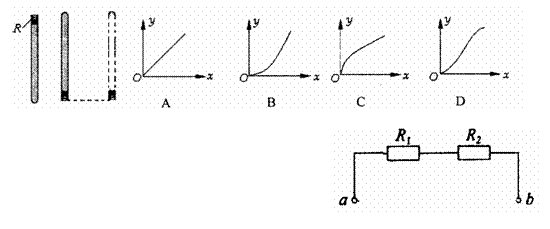
6.如图所示,a、b两端电压恒定,电阻R1=2kΩ,用
内阻也是2kΩ的电压表测电阻R两端电压为2V,
测R2两端电压为4V,则不接电压表时,a、b间总
电压为 ( )
A.6V B.8V
 C.10V D.12V
C.10V D.12V
5.在一端封闭、长约lm的玻璃管内注满清水,水中放一个红蜡做的小圆柱体R,将玻璃管 的开口端用橡胶塞塞紧后,迅速将玻璃管倒置,蜡块沿玻璃管匀速上升,在蜡块上升的同时,让玻璃管沿水平方向向右(设为x方向)做匀加速直线移动,下图中能正确反映蜡块运动轨迹的是 ( )
4.我国于2007年10月发射了探月卫星“嫦娥l号”。假设该卫星的绕月轨道是圆形的,且贴近月球表面。已知月球的质量约为地球质量的l/81,月球的半径约为地球半径的l/4,地球上的第一宇宙速度约为7.9km/s,则该探月卫星绕月运行的速率约为 ( )
A.0.4km/s B.1.8km/s C.1lkm/s D.36km/s
3.如图所示,一物体以初速度v0冲向由光滑板
制成的斜面AB,并恰好能到达斜面顶点B,
物体沿斜面向上运动过程升高h。若物体的
初速度‰不变,下列说法中正确的是( )
A.若增大斜面的倾角,物体仍能沿斜面到达
B点
B.若减小斜面的倾角,物体将冲过B点,所达到最大高度仍为h
C.若斜面保持高h不变,弯成曲面ACB,物体沿此曲面上升仍能到B点
D.若把斜面弯成圆弧形ADB,物体仍能沿圆弧升高h
2.一物体在粗糙的水平面上受到水平拉力作用,在一段时间内
的速度随时间变化情况如右图所示。则拉力的功率随时问
变化的图象可能是下图中的(g取10m/s2) ( )
1.物理学研究表明,自然界存在四种基本相互作用,我们学习过的重力、弹力 ( )
 A.都属于万有引力相互作用
A.都属于万有引力相互作用
B.重力属于万有引力相互作用,弹力属于弱相互作用
C.重力属于强相互作用,弹力属于弱相互作用
D.重力属于万有引力相互作用,弹力属于电磁相互作用
10.(09海南卷 15)(9分)
15)(9分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
9.(09四川卷29)(15分)
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)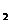 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂郭了电池中,需要一种有机聚合物作为正负极之间锂郭子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
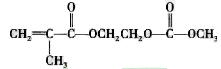
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原是 。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
。
(4)写出M与足量氧化钠溶液反应的化学方程式:
。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
。
答案:
(1)为了防止亚铁化合物被氧化 (3分)
(2)CO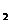 H
H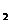 O NH3
(每空1分,共3分)
O NH3
(每空1分,共3分)
(3)Fe+H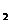 P
P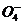 +Li+
+Li+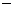 2e
2e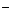 =LiFePO4+2H+
(3分)
=LiFePO4+2H+
(3分)
(4)

(3分)
(5)FePO4+Li++e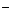 ====LiFePO4
(3分)
====LiFePO4
(3分)
8.(09天津卷 10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
 (用a、b 表示)。
(用a、b 表示)。

 (2)负极反应式为 。
(2)负极反应式为 。
 (3)电极表面镀铂粉的原因为
。
(3)电极表面镀铂粉的原因为
。
 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
 Ⅰ.2Li+H2
Ⅰ.2Li+H2
 2LIH
2LIH
 Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
 ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。

 答案:
答案:
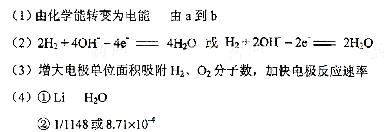
③32
 解析:
解析:
本题考查电化学知识。
(1)原电池的实质为化学能转化成电能。总反应为2H2 + O2 =2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。
(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。
(3)铂粉的接触面积大,可以加快反应速率。
 (4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)= 192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子。
(4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)= 192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子。
7.(09海南卷3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com