
6.[唐山一中2008-2009学年度高三第一学期期中考试](6分)A是一种无色透明的晶体,进行如下实验:
①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色。
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊变红。
③取少量A的溶液加过量氨水,有白色沉淀B生成。
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸。
⑤取少量B滴加氢氧化钠溶液,得无色溶液D。
⑥取少量B滴加盐酸,得无色溶液E。
⑦将47.4g A晶体在120℃下加热脱水,剩余物的质量为25.8g。
根据上述实验现象和结果确定A、B、C,写出它们的化学式。
A: B: C:
答案..(6分) A:KAl(SO4)2·12H2O B:Al(OH)3 C:BaSO4
5.[唐山一中2008-2009学年度高三第一学期期中考试](3分)下列说法或操作正确的是 A、D、F
A.做过碘升华的烧杯和圆底烧瓶可以用四氯化碳或氢氧化钠溶液洗涤
B.做实验时可用手直接拿取金属钠 C.用托盘天平称量50.56gKCl
D.用氯仿可以从饱和碘水中萃取碘 E.用量筒准确量取22.4ml的水
F.从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法
4.[唐山一中2008-2009学年度高三第一学期期中考试]下列实验操作中,先后顺序正确的是[D]
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩埚
C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后再加入硝酸钡溶液
D.在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
3.[唐山一中2008-2009学年度高三第一学期期中考试]配制一定溶质质量分数的NaOH溶液时,造成所配制溶液的溶质质量分数偏高的原因可能是[D]
A.所用NaOH已潮解
B.用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘
C.托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
D.用量筒量取水时,俯视水面刻度线来读取体积
2、(四川省绵阳中学2009届高三二诊模拟试题 学)下列实验方案合理的是( D )
学)下列实验方案合理的是( D )
A.蔗糖水解(H2SO4作催化剂)后,在水解液中加新制的Cu(OH)2悬浊液加热煮沸检验水解产物
B.用氨水清洗做过银镜反应的试管
C.除去苯中的苯酚,加饱和NaHCO3溶液再分液
D.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
1.[四川梓潼一中高2009级高考模拟理科综合考试(A-1)]下列实验操作正确的是( B )
A.中和滴定,锥形瓶用待测液润洗后再使用
B.中和热的测定,读取混合溶液的最高温度为终止温度
C.实验室制氯气,用饱和食盐水吸收尾气
D.蔗糖的水解,在蔗糖溶液中加稀硫酸加热,再加入银氨溶液验证水解产物
22、[江西省安福中学第五次月考试卷]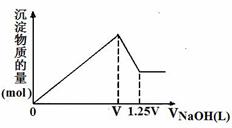 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系
如右图所示,则溶液中MgCl2与Al2(SO4)3的物质的量浓度之比为
A.1:1 B.1:2
C.3:2 D.2:1
Ⅱ([江西省安福中学第五次月考试卷]6分)在一定温度下,向容积不变的容器中加入2 mol N2、8
mol H2 及固体催化剂,使之反应。已知:N2(g)+3H2(g)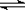 2NH3(g);△H=-92.2 kJ·mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g);△H=-92.2 kJ·mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量__________。
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
 (2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1mol H2 及固体催化剂,反应达到平
衡时NH3的体积分数_______________。
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1mol H2 及固体催化剂,反应达到平
衡时NH3的体积分数_______________。
A.等于0.25 B.大于0.25 C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充 入N2的物质的量a(mol)的取值范围是______________。
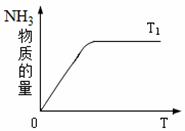
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线, 请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的 变化曲线。
21.[重庆市主城区(五区)2009届普通高中高三联合考试](8分)将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
答案(8分)解:有关化学方程式:
① CuO + H2SO4 === CuSO4 + H2O
②
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O (1分)
CuSO4+SO2↑+2H2O (1分)
设混合物中Cu的物质的量为x,CuO的物质的量为y。
有: 64x + 80y =20.8…………………………①
x + y =0.3………………………………② (1分)
解得:x=0.2mol y=0.1mol (1分)
(1)V(SO2)=0.2mol×22.4L/mol = 4.48L (1分)
(2)已知n(H2SO4)总=0.05L×18.4mol/L=0.92mol (1分)
n(H2SO4)反应=2x + y=0.5mol (1分)
n(H2SO4)余=0.92mol-0.5mol=0.42mol (1分)
故 c(H +)=0.42mol×2÷1L=0.84mol/L (1分)
20.[湘西南名校联盟2009年2月高三联合考试试卷](16分)钢铁工业是国家工业的基础。铁及铁的化合物应用广泛, 如钢铁用于建筑机械等,FeCl3可用于催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
如钢铁用于建筑机械等,FeCl3可用于催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)钢铁吸氧腐蚀正极反应为____________________________________;
(2)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________________。
(3)腐蚀铜板后的混合溶液中,若要除去Cu2+中的Fe3+和Fe2+,请参照下表给出的数据和药品,除去CuCl2溶液中Fe3+和Fe2+的实验步骤 是①用试剂X将Fe2+氧化成Fe3 ;②加入CuO调节溶液的pH至3.2-4.7;③过滤除去Fe(OH)3。
;②加入CuO调节溶液的pH至3.2-4.7;③过滤除去Fe(OH)3。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:X试剂、浓H2SO4、NaOH溶液、CuO、Cu, |
X试剂可以是( )
A.氯气 B.双氧水 C.高锰酸钾 D.次氯酸钠
(4)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应 ,得到CO2气体224 mL(标准状况)。
,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中 ,充分反应后,测得的实验数据如下表所示:
,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
I |
II |
III |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
答案(1) O2+2H2O+4e- =4OH-(3分)
(2)2Fe3++Cu = 2Fe2++Cu2+。(3分)
(3)AB (3分)
(4)①n(C) =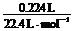 =
0.010 mol,得m(C) =
0.12 g
=
0.010 mol,得m(C) =
0.12 g 。
。
n(Fe):n(C) = 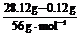 :0.01 mol =
50:1。(3分)
:0.01 mol =
50:1。(3分)
②(4分)从表中可知,实验III中的H2SO4完全反应,所以有:n(H2SO4) = n(H2)  ,
,
即:c(H2SO4)×0.1 L =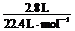 ,得c(H2SO4)
= 1.25 mol·L-1。
,得c(H2SO4)
= 1.25 mol·L-1。
19.[湘西南名校联盟2009年2月高三联合考试试卷]某有机物结构简式为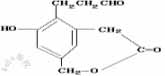 该有机物酸性条件下水解后的生成物分别与金属钠,氢氧化钠,新制氢氧化铜发生反应,从理论上计算出1mol生成物分别与上述三种无机物反应消耗的物质的量 的比为
( C )
该有机物酸性条件下水解后的生成物分别与金属钠,氢氧化钠,新制氢氧化铜发生反应,从理论上计算出1mol生成物分别与上述三种无机物反应消耗的物质的量 的比为
( C )
A.1:1:1 B .3:2:2 C .3:2:3 D.6:4:5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com