
题目列表(包括答案和解析)
8、使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+ 1/2O2(g)=CO(g) △H=-Q1kJ/mol ;CO(g)+1/2 O2(g)=CO2(g)△H=-Q2 kJ/mol 与这些焦炭完全燃烧相比较,损失的热量是( )
A、1/3Q1 kJ B、1/3Q2 kJ C、1/3(Q1+Q2) kJ D、1/2Q2 kJ
7、一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量 是( )
A.0.5Q B.Q C.2Q D.5Q
6、已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)===CO2(g); △H=-393.51 kJ·mol-1
C(金刚石)+O2(g)===CO2(g); △H=-395.41 kJ·mol-1
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
5、已知(1)H2(g)+1/2O2(g)===H2O(g); △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g); △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l); △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l); △H4=d kJ·mol-1
下列关系式中正确的是( )
A、a<c<0 B、b>d>0 C、2a=b<0 D、2c=d>0
4、下列性质中,不能说明乙醇宜作燃料的是( )
A、燃烧时发生氧化还原反应 B、充分燃烧的产物不污染环境
C、乙酸是一种再生能源 D、燃烧时放出大量的热
3、下列说法正确的是( ) www.k@s@5@ 高#考#资#源#网
A、1 mol 硫酸与1mol Ba(OH)2 完全中和所放出的热量为中和热
B、在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D、101 kPa时,1 mol 碳燃烧所放出的热量为碳的燃烧热
2、沼气是一种能源,它的主要成分是CH4。0.5 mol CH4 完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g )+4O2( g)=2CO2( g )+4H2O ( l ) ΔH = +890 kJ/mol
B、CH4+2O2=CO2+H2O ΔH = -890 kJ/mol
C、 CH4 ( g )+2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = -890 kJ/mol
D、 1/2CH4 ( g )+O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/mol
1、下列说法不正确的是( )
A、放热反应不需加热即可发生
B、化学反应过程中的能量变化除了热能外,也可以是光能、电能等
C、需要加热才能进行的化学反应不一定是吸热反应
D、化学反应热效应数值与参加反应的物质多少有关
23、将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)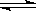 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度及反应开始前容器中A、B的物质的量;
(2)B的平均反应速率;
(3)x的值。
宝丰红星高中学2010--2011学年高二上学期第一次月考
22、(5分)已知298K时下列反应的焓变为
⑴ CH3COOH(l)+2O2(g) = 2CO2(g)+2H2O(l) ∆H1(298K)= -870.3 kJ·mol-1
⑵ C(s)+O2(g) = CO2(g) ∆H2(298K)= -393.5 kJ·mol-1
⑶ H2(g) +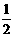 O2(g) = H2O(l)
∆H3(298K) =
-285.8 kJ·mol-1
O2(g) = H2O(l)
∆H3(298K) =
-285.8 kJ·mol-1
计算在此温度下2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应焓变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com