
题目列表(包括答案和解析)
1.下列物质中不能发生水解的是
A.葡萄糖 B.淀粉 C. 油脂 D.蛋白质
32.已知:C(s)+ 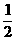 O2(g)====CO(g) ΔH=-110.35 kJ·mol-1,
O2(g)====CO(g) ΔH=-110.35 kJ·mol-1,
CO(g)+ 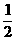 O2(g)====CO2(g) ΔH=-282.57 kJ·mol-1。
O2(g)====CO2(g) ΔH=-282.57 kJ·mol-1。
现将60 g碳全部燃烧,产物恰好为CO和CO2的混合物,测得放出的总热量为1399.49KJ,求所得气体中CO、CO2的物质的量各多少mol
26:(5分)(1):大气污染物根据组成成分可分为颗粒物、硫的氧化物、____________、________、碳氢化合物、以及氟氯代烷等。
(2):常见温室气体按其对温室效应贡献率大小依次为_______、氟氯代烷、CH4、N2O。
(3):室内污染物中主要来自建筑和装饰材料的有________、苯、甲苯、二甲苯等,此外还有一种称为“隐形杀手”的放射性元素污染,此元素是_________。
27:(5分)活化分子之间的碰撞________(填“都是”或“不一定是”)有效碰撞,相同条件下,反应的活化能越小,反应速率越________(填“快”或“慢”),活化能对反应热________(填“有”或“无”)影响,催化剂加快反应速率的原因是它能__________(填“升高”或“降低”)反应的活化能。物质的能量越低,性质越稳定,是因为能量越低,单位体积的活化分子数越_______(填“多”、“少”),越难发生化学反应。
28:(4分)某厂废液中含2%的NaNO2,直接排放会造成污染, NH4Cl能使NaNO2转化为不引起二次污染的N2,反应中NH4Cl是_______ 剂,反应的化学方程式为:
____ ________________。
29:(4分)10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为:ΔH= ______
热化学方程式为 ____________________
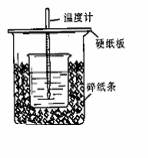 30:(10分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行 中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
30:(10分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行 中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)实验装置中缺少环形玻璃搅伴棒,可否就由温度计代之? ,
(2)除缺少环形玻璃搅伴棒外,右图装置还有一明显的错误是:
__________________________________________________________。
(3)实验前测HCl溶液温度时,温度计放入溶液后在30秒内的刻度变化定时记录数据是:28℃(空调实验室)--27.3℃--26.7℃--26.2℃--25.8℃--25.5℃--25.4℃--25.4℃…,实验开始后的第5秒至60秒时间段里,温度计水银柱对应刻度从5秒时的32℃上升到最高48.3℃后又回落到60秒的42.5℃,必须记录并在计算中使用的温度数据有:________________________(填具体温度数据)。
(4)若50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行实验时测得反应放热经计算为aKJ, 由此可求得其中和热为ΔH=____________________________。
(5)如果用30mL0.50mol/L盐酸与30mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等、不相等”)。
31、(15分)依据事实,写出下列反应的热化学方程式。
⑴在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
⑵若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
⑶用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。___________________________________
(4)25℃、101Kpa下,将1gH2和4gO2混和,在密闭容器中充分燃烧生成液态水,再恢复原条件时,测得放出的热量为71.45KJ,_________________________________。
(5)25℃、101kPa时,10gCaCO3固体在足量稀HCl溶液中完全溶解,放出热量为aKJ,
______________________________________________________。
30.乳酸是一种无色粘绸的液体,易溶于水,可由葡萄糖发酵制取。经测定乳酸和葡萄糖(C6H12O6)的最简式相同,等质量的乳酸和葡萄糖,所含的分子数之比为2:1。
(1)写出乳酸的分子式 ;
(2)已知乳酸分子式中含有羟基、羧基、甲基各一个,写出乳酸的结构简式 ;
(3)1mol乳酸与足量的金属钠反应,在标准状况下生成H2的体积为 L。
(4)乳酸在一定条件下能与乙醇反应,写出其化学方程式 。
29.某化学兴趣小组的同学对实验室乙酸乙酯的制取和分离进行了实验探究。
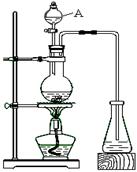 [制备]下列是该小组同学设计的实验装置。回答下列问题:
[制备]下列是该小组同学设计的实验装置。回答下列问题:
(1)仪器A的名称 ▲ ,装置中长导管的主要作用是
▲
(2)证明锥形瓶中收集到乙酸乙酯的简单方法是
▲
[分离]锥形瓶中得到的产物是混合物,为了分离该混合物,设计了如下流程:
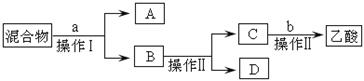
(3)a试剂最好选用 ▲ ;
(4)操作Ⅰ.操作Ⅱ分别是 ▲
A.过滤.分液 B.萃取.蒸馏 C.分液.蒸馏 D.过滤.蒸发
28.利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:

B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:______________▲_______________________,______▲___________反应。
②B→C:____________________▲_______________________,________▲_________反应。
(2)可用于检验A的试剂是____________▲________________________。
27.在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③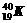 和
和 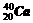
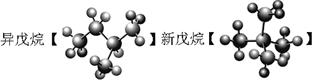
④
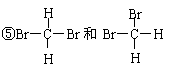
⑥甲烷与丙烷
⑦乙醇(CH3CH2OH)和乙二醇(HO-CH2-CH2-OH)
注意:以上七组物质,不一定是每组物质都能找到对应填空
⑴互为同位素的是 ▲ ;⑵互为同分异构体的是 ▲ ;
⑶互为同系物的是 ▲ ;⑷同一种物质的是 ▲
26.下列说法正确的是
A.所有的糖类、油脂、蛋白质都能发生水解反应
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂有油和脂肪之分,但都属于酯
Ⅱ 非选择题(共72分)
25.大多数水生生物只能在一定的PH范围内的水中生存,你认为这P范围是
A.1~5 B.5~6.5 C.6.5~9.5 D.9~14
24.居室空气污染的主要来源之一是装饰材料释放出的一种刺激性气味的气体,主要成分是
A.甲烷 B.氨气 C.甲醛 D.二氧化硫
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com