
21.(10分)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物。
方法一:将天青石粉碎后在1000-1200℃时与碳在还原气氛中反应制得硫化锶。向硫化锶溶液中通入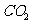 得到碳酸锶。
得到碳酸锶。
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加入1-2h,经过滤、洗涤,得到碳酸锶。
(1)方法一将天青石粉碎的目的是 。
写出用碳还原天青石反应的化学方程式:
(2)方法二的反应能够发生,说明
为了使该反应充分进行,还可以采取的措施是 。
(3)两种方法中得到的碳酸锶纯度较高的是 (填“方法一”或“方法二”),理由是 。
(4)下列关于锶及其化合物的叙述中,正确的是 。
A.离子半径: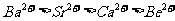
B.碱性: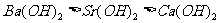
C.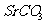 高温分解可以制取SrO
高温分解可以制取SrO
D.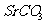 与
与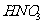 溶液反应可制取
溶液反应可制取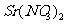
20.(10分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如图所示的关系。
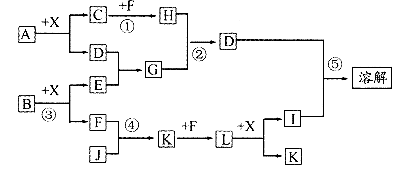
(1)写出化学式:A ;B ;J
(2)反应③中每生成l mol F,转移电子的数目为
(3)反应④的化学方程式为
(4)写出离子方程式:
②
⑤
(5)反应①中,每l.00g C与足量的F作用,恢复到25℃放出55.6KJ热量,写出反应①的热化学方程式: 。
19.(8分)X、Y、Z三种短周期元素,它们之间的化合物有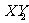 、
、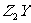 、
、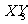 、
、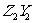 、
、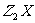 等。已知
等。已知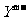 与
与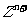 两种离子具有相同的电子层结构;
两种离子具有相同的电子层结构;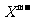 离子比
离子比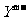 离子多一电子层。试回答:
离子多一电子层。试回答:
(1)X原子的原子结构示意图是 ,它处于周期表中第 周期 族。
(2)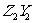 的电子式为 ,
的电子式为 ,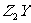 的电子式为 。
的电子式为 。
(3)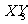 在标况下是针状晶体,属于 晶体。又知
在标况下是针状晶体,属于 晶体。又知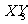 的水化物与
的水化物与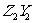 反应可生成一种具有漂白性的强氧化剂
反应可生成一种具有漂白性的强氧化剂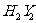 ,推测反应时的化学方程式为
,推测反应时的化学方程式为
(4)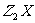 属于 晶体。
属于 晶体。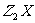 的水溶液和
的水溶液和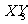 的水化物在溶液中反应的离子方程式是 。
的水化物在溶液中反应的离子方程式是 。
18.(12分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了如下图所示装置进行有关实验。
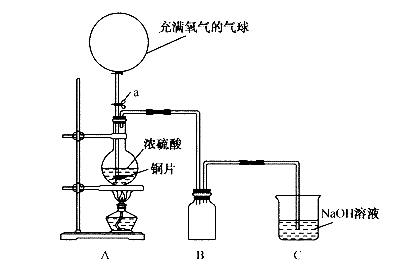
(1)先关闭活塞a,将6.4g铜片和12 mL18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入网底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式: , ;
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
③实验结束后,装置C中的溶液中可能含有的溶质有 。
(2)事实表明。上述反应全部结束后.硫酸仍有剩余。为定量测定剩余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生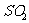 的量。再通过计算确定剩余酸的物质的量浓度。他认为测定
的量。再通过计算确定剩余酸的物质的量浓度。他认为测定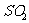 的量的方法有多种,请你写出其中的一种:
的量的方法有多种,请你写出其中的一种:
②乙学生设计的方案是:将反应后的溶液冷却后全部移入100 ml,容虽瓶中并加蒸馏水定容,取20 mL于锥形瓶中。用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量浓度。你认为乙学生设计的实验方案能否准确求得余酸的物质的量的浓度? (填“能”或“否”),理由是
17.(10分)(1)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒人3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
(2)①现有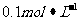 的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 ,纯碱溶液呈碱性的原因是(用离子方程式表示)
的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 ,纯碱溶液呈碱性的原因是(用离子方程式表示)
②为探究纯碱溶液呈碱性是由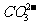 引起的,设计一个简单的实验方案。
引起的,设计一个简单的实验方案。
16.下列各组离子,在指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液: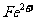 、
、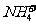 、
、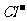 、
、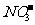
B.pH为11的溶液: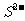 、
、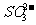 、
、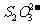 、
、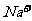
C.水电离出来的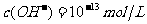 的溶液:
的溶液: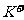 、
、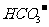 、
、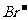 、
、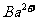
D.所含溶质为NaCl的溶液: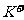 、
、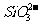 、
、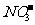 、
、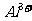
15.可逆反应mA(气)nBp C(气)qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
C(气)qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明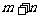 一定等于
一定等于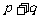
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率并不都增大
14.镁、铝、铁种金属的混合物与足量的稀盐酸反应,生成2.80L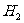 (标准状况),则三种金属的物质的量之和不可能是
(标准状况),则三种金属的物质的量之和不可能是
A.0.120mol B.0.090 mol C.0.080 mol D.0.100 mol
13.某二元弱酸(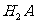 )溶液按下式发生一级和二级电离:
)溶液按下式发生一级和二级电离: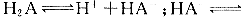
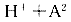 ,已知相同浓度时的电离度
,已知相同浓度时的电离度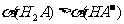 ,则
,则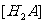 浓度最大的是
浓度最大的是
A.0.01 mol/L的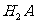 溶液
溶液
B.0.01 mol/L的NaHA溶液
C.0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合
D.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合
12.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为: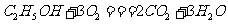 ,电池示意图如图所示,下列说法不正确的是
,电池示意图如图所示,下列说法不正确的是
A.a极为电池的阳极,该电极发生还原反应
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为: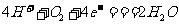
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com